
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. | CH2=CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl | ||
| C. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | D. | 2C6H6+15O2$\stackrel{点燃}{→}$12CO2+6H2O |
分析 有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应是加成反应;有机物中的原子或原子团被其他的原子或原子团所代替生成新的化合物的反应叫取代反应,根据定义分析解答.
解答 解:A、甲烷和氯气混合光照后,甲烷中的氢原子被氯原子所代替生成氯代物而使黄绿色消失,属于取代反应,故A错误;
B、乙烯在催化剂作用下与HCl反应生成一氯乙烷,属于加成反应,故B正确;
C、乙醇与氧气发生氧化反应生成二氧化碳和水,属于氧化反应,不属于加成,故C错误;
D、苯与氧气发生氧化反应生成二氧化碳和水,不属于加成反应,属于氧化反应,故D错误;
故选B.
点评 本题主要考查了加成反应的判断,难度不大,注意:乙烯含有碳碳双键,所以性质较活泼,容易发生加成反应.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 稳定性 PH3<H2S<HCl | B. | 沸点高低 NH3<PH3<AsH3 | ||
| C. | 还原性 Br-<Fe2+<I- | D. | 微粒半径 K+<Cl?<S2? |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
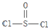 )是一种很重要的化学试剂,可以作为氯化剂和脱水剂.氯化亚砜分子的几何构型是三角锥形;中心原子采取SP3杂化方式.
)是一种很重要的化学试剂,可以作为氯化剂和脱水剂.氯化亚砜分子的几何构型是三角锥形;中心原子采取SP3杂化方式.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当一个可逆反应达到平衡状态时,就是这个反应在该条件下所能达到的限度 | |
| B. | 当一个可逆反应进行到平衡状态时,那么这个反应的正逆反应速率相等 | |
| C. | 平衡状态是一种静止的状态,因此反应物和生成物的浓度已经不再改变 | |
| D. | 化学反应的限度可以通过改变条件而改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 已知 | 类推 | |
| A | 将铁加到硫酸铜溶液中 Fe+Cu2+=Fe2++Cu | 将钾加到硫酸铜溶液中 2K+Cu2+=2K++Cu |
| B | 向Ca(ClO)2溶液中通入CO2气体 Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入SO2气体 Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| C | 将少量碳酸钙粉末投入到足量的盐酸中 CaCO3+2H+=Ca2++CO2↑+H2O | 将少量碳酸钙粉末投入到足量的硝酸溶液中 CaCO3+2H+=Ca2++CO2↑+H2O |
| D | SO2气体通入BaCl2溶液中,不反应,因为H2SO3的酸性弱于盐酸 | SO2气体通入Ba(NO3)2溶液中也不反应,因为H2SO3的酸性弱于硝酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤法 | B. | 萃取法 | C. | 分液法 | D. | 蒸馏法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol | B. | 0.02 mol | C. | 0.03 mol | D. | 0.04 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食品包装袋、食物保鲜膜等材料的主要成份是聚氯乙烯 | |
| B. | 煤经过气化和液化两个物理变化,可变为清洁能源 | |
| C. | 蛋白质只含C、H、O、N四种元素 | |
| D. | 凡含有食品添加剂的食物对人体健康均有害,不可食用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com