
| A. |  | B. | 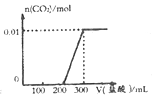 | ||
| C. |  | D. | 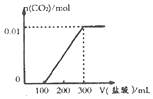 |
分析 0.4g NaOH的物质的量为$\frac{0.4g}{40g/mol}$=0.01mol,1.06g Na2C03的物质的量为$\frac{1.06g}{106g/mol}$=0.01mol,向NaOH和混合溶液中滴加0.1mol•L-1的盐酸,先发生氢氧化钠与盐酸的中和反应,再发生碳酸钠与盐酸的反应生成碳酸氢钠和氯化钠,最后发生碳酸氢钠与盐酸反应才有二氧化碳气体生成,利用物质的量的关系并结合图象解答该题.
解答 解:A.加入0.1L盐酸,n(HCl)=0.1L×0.1mol/L=0.01mol,0.01mol盐酸与氢氧化钠反应没有气体生成,再加入0.01molHCl,与0.01mol碳酸钠恰好反应生成碳酸氢钠,也没有气体生成,则图象与实际不符,故A错误;
B.向NaOH和Na2CO3混合溶液中滴加盐酸时,首先和NaOH反应生成水和氯化钠,当滴入0.1L时,两者恰好反应完全;继续滴加时,盐酸和Na2CO3开始反应,首先发生HCl+Na2CO3=NaHCO3+NaCl,不放出气体,当再加入0.1L时,此步反应进行完全;继续滴加时,发生反应:NaHCO3+HCl=NaCl+H2O+CO2↑,此时开始放出气体,再消耗0.1L盐酸,生成二氧化碳达最大,图象与实际相符合,故B正确;
C.图象中开始反应即有气体生成,与反应不符,故C错误;
D.因碳酸钠与盐酸的反应分步完成,则碳酸钠与盐酸先反应生成碳酸氢钠和氯化钠,此时没有气体生成,则图象与反应不符,故D错误;
故选B.
点评 本题考查了元素化合物、图象数据的处理知识,为高频考点,侧重考查学生的分析能力,解答此题的易错点是,不能准确理解向碳酸钠溶液中滴加盐酸的反应.是分步进行的,首先发生的是HCl+Na2CO3=NaHCO3+NaCl;进行完全后,再发生:NaHCO3+HCl=NaCl+H2O+CO2↑.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
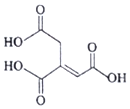
| A. | 化学式为C6H6O6 | |
| B. | 乌头酸含有三种官能团 | |
| C. | 乌头酸能使酸性高锰酸钾溶液褪色 | |
| D. | 含l mol乌头酸的溶液最多可消耗3 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的摩尔质量是44g | |
| B. | 1mol CO2的体积约为22.4L | |
| C. | 1mol CO2的质量是44g/mol | |
| D. | 1mol CO2中所含分子数约为6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅元素在自然界里均以化合态存在 | |
| B. | SiO2不能与水反应生成硅酸,不是酸性氧化物 | |
| C. | 除去二氧化硅中少量的碳酸钙杂质应选用水 | |
| D. | 粗硅制备时,发生的反应为C+SiO2=Si+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究小组设计如图所示实验装置(夹持及控温装置省略),用Cu(NO3)2•3H2O晶体和SOCl2制备少量无水Cu(NO3)2.已知SOC12熔点-l05℃、沸点76℃、遇水剧烈水解生成两种酸性气体..
某研究小组设计如图所示实验装置(夹持及控温装置省略),用Cu(NO3)2•3H2O晶体和SOCl2制备少量无水Cu(NO3)2.已知SOC12熔点-l05℃、沸点76℃、遇水剧烈水解生成两种酸性气体..| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+• | 4.2 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ?263 | B. | +263 | C. | ?352.1 | D. | +131.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
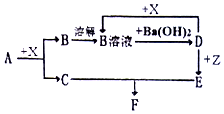 下列物质均为常见物质或它们的溶液,其中A为淡黄色固休,C、X均为无色气体,Z为浅绿色溶液,D为一种常见的强碱.根据它们之间的转化关系(如图),用化学用语回答问题.(部分产物已省略)
下列物质均为常见物质或它们的溶液,其中A为淡黄色固休,C、X均为无色气体,Z为浅绿色溶液,D为一种常见的强碱.根据它们之间的转化关系(如图),用化学用语回答问题.(部分产物已省略) .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度(℃) CO2 浓度 (mol/L) 时间(min) | 15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 3×10-3 | 0.9×10-2 | 2.7×10-2 |
| t2 | 1×10-3 | 1.6×10-2 | 3.1×10-2 |
| t3 | 1×10-3 | 1.6×10-2 | 3.1×10-2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com