
| A. | 向NaHCO3溶液中加入过量的石灰水产生白色沉淀:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| B. | 向AgCl悬浊液中滴加Na2S溶液产生黑色沉淀:2AgCl(s)+S2-═Ag2S(s)+2Cl- | |
| C. | 石灰乳中Ca(OH)2的电离:Ca(OH)2(s)═Ca2++2OH- | |
| D. | Fe(OH)3胶体的制备:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl |
分析 A.碳酸氢钠完全反应,生成碳酸钙、水、NaOH;
B.发生沉淀的转化;
C.存在溶解平衡;
D.铁离子水解生成胶体.
解答 解:A.向NaHCO3溶液中加入过量的石灰水产生白色沉淀的离子反应为HCO3-+Ca2++OH-═CaCO3↓+H2O,故A正确;
B.向AgCl悬浊液中滴加Na2S溶液产生黑色沉淀的离子反应为2AgCl(s)+S2-═Ag2S(s)+2Cl-,故B正确;
C.石灰乳中Ca(OH)2的存在Ca(OH)2(s)?Ca2++2OH-,故C错误;
D.Fe(OH)3胶体的制备的化学反应为FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl,故D正确;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重与量有关的离子反应、水解反应及沉淀转化的离子反应考查,注意离子反应中保留化学式的物质及电荷守恒,题目难度不大.


科目:高中化学 来源: 题型:解答题
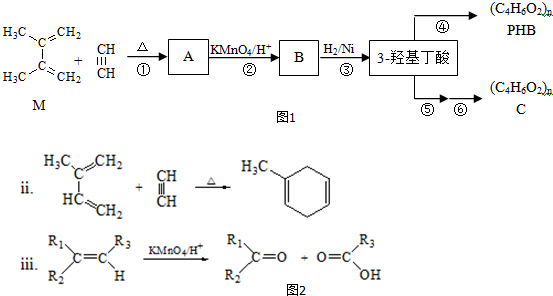
 .
. ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电离时能够产生H+的化合物是酸 | |
| B. | 难溶的物质(如CaCO3)不能发生离子反应 | |
| C. | 电解质在水中不一定能导电,在水中导电的化合物不一定是电解质 | |
| D. | 胶体加入电解质可产生沉淀,而溶液不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
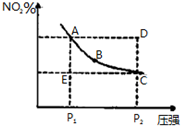
| A. | A、C两点的正反应速率的关系为A>C | |
| B. | A、B、C、D、E各状态中,v(正)<v(逆)的是状态E | |
| C. | 维持P1不变,E→A所需时间为x;维持P2不变,D→C所需时间为y,则x<y | |
| D. | 使E状态从水平方向到达C状态后,再沿平衡曲线到达A状态,从理论上来讲,可选用的条件是从P1突然加压至P2,再由P2无限缓慢降压至P1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
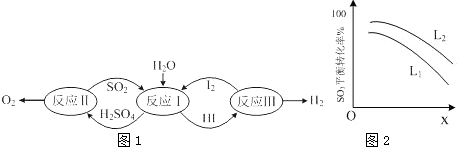
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2v(NH3)=v(CO2) | B. | 密闭容器中c(NH3):c(CO2)=2:1 | ||
| C. | 密闭容器中体积不变 | D. | 密闭容器中混合气体的密度不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com