
【题目】(1)元素周期表是我们研究物质性质、结构的重要工具,对周期表的熟悉和掌握程度直接影响我们对化学的学习。元素周期表共有七个周期十六个族;第ⅠA族元素(除氢外)的最高价氧化物对应水化物都是易溶于水的强碱,又称为___元素,卤族元素位于第__纵行,最高正价与最低负价的绝对值相等的元素位于___族。
(2)A、B、C、D、E、F、G为原子序数依次增大的前20号元素(此时不考虑稀有气体元素),在周期表中B和C,C和E分别相邻,B、E、G的最外层电子数之和为12。已知部分元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
A | 该元素有一种核素质量数为1 |
B | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
D | 原子的次外层电子数是最外层电子数的两倍 |
①由元素A、B形成的核外电子总数为10e-的两种微粒:___,___(写化学式)。
②C元素在周期中的位置:___。
③C、D形成的化合物在通讯上的重要用途___。
④E与G两元素可形成化合物,用电子式表示其化合物的形成过程:___。
⑤用化学方程式表示B、D两种元素的非金属性强弱___。
⑥A、B、F三种元素形成的一种常见化合物易溶于水,受热易分解,可用于制作干电池,该物质的电子式是___。
【答案】碱金属 17 ⅣA NH3或NH4+ NH2- 第二周期第ⅥA族 光导纤维 ![]() 2HNO3+Na2SiO3=2NaNO3+H2SiO3↓
2HNO3+Na2SiO3=2NaNO3+H2SiO3↓ 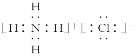
【解析】
(1)结合元素周期表结构及元素在元素周期表中的排布进行分析解答;
(2)由题干信息,A、B、C、D、E、F、G为原子序数依次增大的前20号元素(此时不考虑稀有气体元素),A元素有一种核素质量数为1,则A为H元素,B在常温下的单质为双原子分子,其氢化物水溶液呈碱性,则B为N元素,D原子的次外层电子数是最外层电子数的两倍,则D为Si元素,在周期表中B和C,C和E分别相邻,则C为O元素,E为S元素,B、E、G的最外层电子数之和为12,则G的最外层电子数为12-6-5=1,则G为K元素,则F为Cl元素,据此分析解答。
(1)元素周期表共有七个周期16个族,第ⅠA族元素(除氢外)的最高价氧化物对应水化物都是易溶于水的强碱,又称为碱金属元素,卤族元素位于第ⅦA族,为元素周期表的第17纵行,最高正价与最低负价的绝对值相等的元素位于第ⅣA族,故答案为:碱金属;17;ⅣA;
(2)根据上述分析可知,A为H元素,B为N元素,C为O元素,D为Si元素,E为S元素,F为Cl元素,G为K元素;
①有H元素和N元素形成的核外电子总数为10e-的微粒有NH3、NH4+、NH2-,故答案为:NH3或NH4+;NH2-;
②C为O元素,是8号元素,位于元素周期表的第二周期第ⅥA族,故答案为:第二周期第ⅥA族;
③O元素和Si元素形成的化合物为二氧化硅,是光导纤维的主要材料,故答案为:光导纤维;
④S元素和K元素形成的化合物为K2S,是离子化合物,其形成过程用电子式表示为![]() ,故答案为:
,故答案为:![]() ;
;
⑤2HNO3+Na2SiO3=2NaNO3+H2SiO3↓可说明酸性HNO3>H2SiO3,HNO3、H2SiO3分别为N、Si的最高价含氧酸,因此非金属性N>Si,故答案为:2HNO3+Na2SiO3=2NaNO3+H2SiO3↓;
⑥H、N、Cl形成的一种常见化合物易溶于水,受热易分解,可用于制作干电池,则该化合物为NH4Cl,NH4Cl为离子化合物,电子式为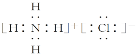 ,故答案为:
,故答案为: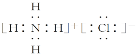 。
。


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
【题目】酶在生命活动和工业生产中都有很好的催化效果。有下列物质的转化关系:

请回答:
(1)E→F 的反应类型_______________;
(2)有机物 B、 C 都含有的官能团名称___________________;
(3)写出 C 与 F 在浓硫酸加热条件下发生反应的化学方程式__________________;
(4)写出C在一定条件下发生缩聚反应生成产物的结构简式____________________;
(5)写出与G含有相同官能团且能发生银镜反应的一种同分异构体______________;
(6)下列说法正确的是_______。
A.可以用 NaOH 溶液鉴别物质 B、C、D
B.等物质的量的C 和 D 分别与足量的钠反应,产生等物质的量的氢气
C.葡萄糖和E均可以发生银镜反应
D. 物质 F 一定条件下可以转化为 E,E也可以转化为D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行了有关Cu、硝酸、硫酸化学性质的实验,实验过程如下图所示。下列有关说法正确的是
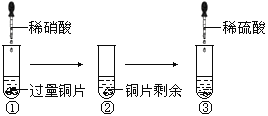
A. 实验①中溶液呈蓝色,试管口有红棕色气体产生,说明稀硝酸被Cu还原为NO2
B. 实验③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
C. 实验③发生反应的化学方程式为:3Cu+Cu(NO3)2+4H2SO4=4CuSO4+2NO↑+4H2O
D. 由上述实验可得出结论:Cu在常温下既可以和稀硝酸反应,也可以和稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修3:物质结构与性质]太阳能电池板材料除单品硅外,还有含铜、铟、镓、硒等元素的化学物质。
(1)基态硅原子的价电子轨道表达式__________。
(2)有一类组成最简单的有机硅化合物叫硅烷。硅烷的组成、结构与相应的烷烃相似。硅烷中硅采取________杂化方式,硅烷的沸点与相对分子质量的关系如下图所示现这种变化的原因是_________。

(3)硒和硫同为VIA族元素,与其相邻的元素有砷和溴,则三种元素的电负性由小到大的顺序为____________(用元素符号表示)。
(4)气态SeO3分子的立体构型为_________,与SeO3互为等电子体的一种阴离子为_______(填化学式)。
(5)CuCl的盐酸溶液吸收CO形成氯化羰基亚铜[CuCl(CO)2 H2O,通常形成二聚体,结构示意图如下。则该化合物中与Cu+形成配位键的原子是_________。

(6)—种铜金合金晶体具有面心立方最密堆枳结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中铜原子(Cu)与金原子(Au)个数比为____________,若该晶体的晶胞棱长为a nm,则该合金密度为____________(列出计算式,不要求计算结果,阿伏加徳罗常数的值为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲测定金属镁的相对原子质量,请利用下图给定的仪器组成一套实验装置(每个仪器只能使用一次,假设气体的体积可看作标准状况下的体积)。

填写下列各项(气流从左到右):
(1)各种仪器连接的先后顺序是__________接________、________接________、________接________、________接________(用小写字母表示)。
(2)连接好仪器后,要进行的操作有以下几步,其先后顺序是________________(填序号)。
①待仪器B中的温度恢复至室温时,测得量筒C中水的体积为Va mL;
②擦掉镁条表面的氧化膜,将其置于天平上称量,得质量为m g,并将其投入试管B中的带孔隔板上;
③检查装置的气密性;
④旋开装置A上分液漏斗的活塞,使其水顺利流下,当镁完全溶解时再关闭这个活塞,这时A中共放入水Vb mL。
(3)根据实验数据可算出金属镁的相对原子质量,其数学表达式为___________________。
(4)若试管B的温度未冷却至室温,就读出量筒C中水的体积,这将会使所测定镁的相对原子质量数据________(填“偏大”“偏小”或“无影响”)。
(5)仔细分析上述实验装置后,经讨论认为结果会有误差,于是又设计了如下图所示的实验装置。

①装置中导管a的作用是_________________________________________。
②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为____________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
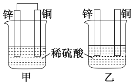
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的c(H+)均减小
D.产生气泡的速率甲比乙慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要的有机化工原料,可由乙醇脱水制备。涉及反应如下:
①2CH3OH(g)![]() CH3OCH3(g)+ H2O(g) △H1=—23.9 kJmol-1
CH3OCH3(g)+ H2O(g) △H1=—23.9 kJmol-1
②2CH3OH(g)![]() C2H4(g)+2H2O(g) △H2= —29.1kJmol-1
C2H4(g)+2H2O(g) △H2= —29.1kJmol-1
③CH3CH2OH(g)![]() CH3OCH3(g) △H3= +50.7kJmol-1
CH3OCH3(g) △H3= +50.7kJmol-1
④C2H5OH(g)![]() C2H4(g)+ H2O(g) △H4=akJmol-1
C2H4(g)+ H2O(g) △H4=akJmol-1
回答下列问题:
(1)a=___________。
(2)在1.0L密闭容器中放入0.10 mol C2H5OH(g),在一定温度下进行④反应,反应时间(t)与容器内气体总压强(P)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强P/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
①欲提高C2H5OH的平衡转化率,应采取的措施为___________(填字母)。
a.升高温度 b.增大压强
c.通入乙醇 d.降低压强
②由总压强P和起始压强P0计算反应物C2H5OH的转化率(C2H5OH)的表达式为_________,平衡时C2H5OH的转化率为_______(结果保留两位有效数字,下同),该反应的平衡常数K=_________。
③用总压强P和起始压强P0表示反应体系的总物质的量n(总)和反应物C2H5OH的物 质的量n(C2H5OH),n(总)=_____mol,n(C2H5OH)=_____mol。
(3)下表为反应④中反应物浓度与反应时间的数据,分析该反应中c(C2H5OH)变化与时间间隔(△t)的规律,得出的结论是______,由此规律推出反应在12h时c(C2H5OH)等于______molL-1
反应时间t/h | 0 | 4 | 8 | 16 |
c(C2H5OH)/(molL-1) | 0.10 | 0.051 | 0.026 | 0.0065 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 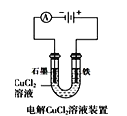 中阳极处能产生使湿润淀粉KI试纸变蓝的气体
中阳极处能产生使湿润淀粉KI试纸变蓝的气体
B. 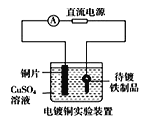 中待镀铁制品应与电源正极相连
中待镀铁制品应与电源正极相连
C. 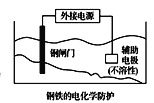 中钢闸门应与外接电源的正极相连,称为牺牲阳极的阴极保护法
中钢闸门应与外接电源的正极相连,称为牺牲阳极的阴极保护法
D. 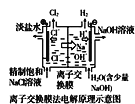 中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同周期,C、D、E同处另一周期,C、A可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙,B是最活泼的非金属元素,D是地壳中含量最高的金属元素,E的最高价氧化物对应的水化物是周期表中最强的含氧酸。
(1)元素B在周期表中的位置是_________,甲的电子式是_______。
(2)单质D与C的最高价氧化物对应水化物的水溶液反应的离子方程式是___________。
(3)单质E与C的最高价氧化物对应水化物的水溶液反应的化学方程式是________。
(4)物质乙与水反应的化学方程式____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com