
分析 (1)根据反应速率v=$\frac{△c}{△t}$=$\frac{\frac{△n}{V}}{△t}$可计算出v(O2);
(2)2min时,SO2的浓度c(SO2)2min=c(SO2)初始-c(SO2)变化;
(3)计算出放出的热量,再根据热化学方程式书写解答.
解答 解:(1)2min内,以O2表示的平均反应速率为:v(O2)=$\frac{\frac{2mol-1.6mol}{2L}}{2min}$=0.1mol/(L•min),
故答案为:0.1mol/(L•min);
(2)2min内O2的浓度变化量为:△c(O2)=$\frac{2mol-1.6mol}{2L}$=0.2mol/L;浓度变化量等于化学计量数之比,则△c(SO2)=2△c(O2)=2×0.2mol/L=0.4mol/L,2min时,所以SO2的浓度c(SO2)2min=c(SO2)初始-c(SO2)变化=$\frac{2mol}{2L}$-0.4mol/L=1.1mol/L,
故答案为:1.1mol/L;
(3)2min内,O2的物质的量变化量△n(O2)=2mol-1.6mol=0.4mol,此时放出的热量为Q kJ,该反应的热化学方程式为2SO2(g)+O2(g)?2SO3(g)△H=-2.5QkJ•mol-1,
故答案为:2SO2(g)+O2(g)?2SO3(g)△H=-2.5QkJ•mol-1.
点评 本题考查了化学平衡的计算,题目难度中等,明确化学平衡及其影响因素为解答关键,注意掌握热化学方程式的书写原则及反应速率的表达式,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:多选题
| A. | 除去乙烷中的少量乙烯:催化剂和加热条件下通入足量的H2 | |
| B. | 除去乙醇中少量的水:加新制生石灰,蒸馏 | |
| C. | 除去溴苯中少量苯:分液 | |
| D. | 除去硝基苯中的HNO3和H2SO4:加入足量NaOH溶液分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是含碳元素的化合物都属于有机物 | |
| B. | 易溶于汽油、酒精、苯等有机溶剂中的物质一定是有机物 | |
| C. | 液化石油气(LPG)主要成分是甲烷 | |
| D. | 电石气燃烧放出大量热,常常用于焊接或切割金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷分子的比例模型: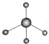 | B. | 甲基的电子式: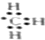 | ||
| C. | 乙烷的分子式:CH3CH3 | D. | 丙烷的结构式:CH3CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 四 | ⑨ | ⑩ |
 .
. ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.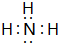 ,该化合物是由极性(填“极性”或“非极性”)键形成的.
,该化合物是由极性(填“极性”或“非极性”)键形成的.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子的半径:Y>X | |
| B. | 氢化物的稳定性:Z>W | |
| C. | X与Z形成的化合物溶于水所得溶液显碱性 | |
| D. | Y与W形成的化合物溶于水所得溶液显酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com