
【题目】(化学——有机化学基础)
聚酰胺—66常用于生产帐篷、渔网、降落伞及弹力丝袜等织物,可利用下列路线合成:

已知反应:![]()
(1)能与银氨溶液反应的B的同分异构体的结构简式为_________________,
(2)D的结构简式为____________,①的反应类型为_____________,
(3)为检验D中的官能团,所用试剂包括NaOH水溶液及___________,
(4)由F和G生成H的反应方程式为____________________________________________。
【答案】CH3CH2CH2CHO和(CH3)2CHCHO CH2ClCH2CH2CH2Cl 取代反应 HNO3和AgNO3 nHOOC(CH2)4COOH+nH2N(CH2)6NH2→![]() +(2n-1)H2O
+(2n-1)H2O
【解析】
由合成流程图可知,A经H2加成得到环丁醚B,B与HCl加成得到C氯代丁醇,再进行一步取代得D,D为CH2ClCH2CH2CH2Cl;通过反应①取代得到己二腈,结合所给信息可知F是己二酸,G是己二胺,通过缩聚反应得到H(聚酰胺-66),然后结合有机物的结构与性质来解答。
(1)B分子式是C4H8O,符合饱和一元醛的通式,能与银氨溶液反应的B的同分异构体含-CHO,其结构简式为CH3CH2CH2CHO和(CH3)2CHCHO,故答案为:CH3CH2CH2CHO和(CH3)2CHCHO;
(2)由上述分析可知,D为CH2ClCH2CH2CH2Cl;反应①的反应中-Cl被-CN取代,属于取代反应,故答案为:CH2ClCH2CH2CH2Cl;取代反应;
(3)D中官能团为-Cl,要检验氯代烃中氯元素,应先通过NaOH溶液水解,然后加硝酸至酸性再用AgNO3溶液检验Cl-,故答案为:硝酸和硝酸银;
(4)F是HOOC(CH2)4COOH,G是H2N(CH2)6NH2,两者发生缩聚反应生成H,反应方程式为nHOOC(CH2)4COOH+nH2N(CH2)6NH2→![]() +(2n-1)H2O,
+(2n-1)H2O,
故答案为:nHOOC(CH2)4COOH+nH2N(CH2)6NH2→![]() +(2n-1)H2O。
+(2n-1)H2O。


科目:高中化学 来源: 题型:
【题目】锂离子电池历经半个世纪岁月的考验,作出重大贡献的三位科学家被授予2019 年诺贝尔化学奖。磷酸亚铁锂( LiFePO4)是新型锂离子电池的正极材料。某小组拟设计以一种锂辉石(主要成分为Li2O· Al2O3·4SiO2,含少量铁、钙、镁)为原料制备纯净的碳酸锂,进而制备LiFePO4的工艺流程:
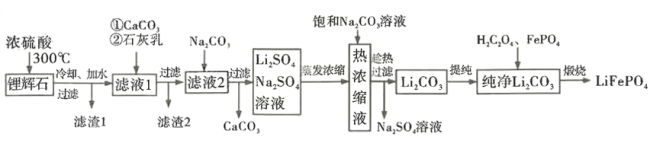
已知:LiO2·Al2O3·4SiO2+H2SO4(浓) ![]() Li2SO4+Al2O3·4SiO2·H2O↓
Li2SO4+Al2O3·4SiO2·H2O↓
回答下列问题:
(1) LiFePO4含有锂、铁两种金属元素,它们焰色反应的颜色分别是_____________(填序号)。
A.紫红色、无焰色反应 B.黄色、无焰色反应
C.黄色、紫色 D.洋红色、黄绿色
(2)滤渣1的主要成分是_____________;向滤液1中加入适量的CaCO3细粉用于消耗硫酸并将Fe3+转化为红褐色沉淀,若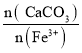 =3,反应的离子方程式为__________; 滤渣2的主要成分是Fe(OH)3、________、 CaSO4,其中 Fe(OH)3 脱水后可生成一种元素种类不变且摩尔质量为89 g·mol -1的新化合物,其化学式为_______________。
=3,反应的离子方程式为__________; 滤渣2的主要成分是Fe(OH)3、________、 CaSO4,其中 Fe(OH)3 脱水后可生成一种元素种类不变且摩尔质量为89 g·mol -1的新化合物,其化学式为_______________。
(3)已知碳酸锂在水中的溶解度随温度升高而减小,上述流程中趁热过滤的目的是________。
(4)煅烧制备LiFePO4时,反应的化学方程式为_____________________。
(5)某种以LiFePO4,作正极材料的锂电池总反应可表示为: LiFePO4+C![]() Li1-xFePO4 +CLix。放电时正极的电极反应式为__________。
Li1-xFePO4 +CLix。放电时正极的电极反应式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁铝尖晶石(MgAl2O4)常做耐火材料。共沉淀制备尖晶石的方法是:用AlCl3和MgCl2的混合溶液(用a表示)与过量的氨水(用b表示)反应,再将得到的沉淀高温焙烧。完成下列填空:
(1)为使Mg2+、Al3+同时生成沉淀,应该把_____(填“a”或“b”)滴入另一溶液中。
(2)将上述制备反应中部分元素的简单离子:Al3+、Cl–、Mg2+、H+、O2–按半径由大到小的顺序排列
______________________(用离子符号表示)。
(3)AlCl3与氨水反应的反应物和生成物中,属于离子化合物的电子式是_________,属于难溶物的电离方程式_____________________________。
(4)不能说明氧元素的非金属性比氮元素强的事实是_________。
a. H2O比NH3稳定 b. 共用电子对偏向:H-O>H-N
c. 沸点:H2O>NH3 d. NO中氮是+2价,氧是-2价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,2NH3(g)+NaClO(aq)=NaCl(aq)+N2H4(aq)+H2O(l)能自发进行,可用于生产N2H4。下列有关说法正确的是
A.该反应的△H>0,△S<0
B.每生成1mol N2H4转移2mol电子
C.室温下,向0.lmol/L NaClO溶液中加水,溶液pH增大
D.N2H4、O2和KOH溶液组成的燃料电池,负极反应为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. NO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构
B. P4和CH4都是正四面体形分子且键角都为109°28′
C. NH4+的电子式为 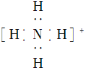 ,离子呈平面正方形结构
,离子呈平面正方形结构
D. NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。设起始
CO(g)+3H2(g)。设起始![]() =Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示。下列说法正确的是
=Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示。下列说法正确的是
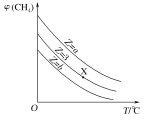
A.该反应的焓变ΔH<0
B.图中Z的大小为a<3<b
C.图中X点对应的平衡混合物中![]() =3
=3
D.温度不变时,图中X点对应的平衡在加压后φ(CH4)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷在加热条件下可还原氧化铜,气体产物除水蒸气外,还有碳的氧化物,某化学小组利用如图装置探究其反应产物。
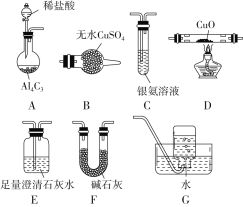
(查阅资料)
①CO能与银氨溶液反应:CO+2Ag(NH3)2++2OH-=2Ag↓+2NH4++CO32-+2NH3;
②Cu2O为红色,不与Ag+反应,发生反应:Cu2O+2H+=Cu2++Cu+H2O。
(1)装置A中反应的化学方程式为__________________________。
(2)按气流方向各装置从左到右的连接顺序为A→_____________________。
(3)实验中滴加稀盐酸的操作是_________________________。
(4)已知气体产物中含有CO,则装置C中可能观察到的现象是___________________________;装置F的作用为____________________。
(5)当反应结束后,装置D处试管中固体全部变为红色。
①设计实验证明红色固体中含有Cu2O:______;
②欲证明红色固体中是否含有Cu,甲同学设计如下实验:向少量红色固体中加入适量的0.1 mol/L AgNO3溶液,发现溶液变蓝,据此判断红色固体中含有Cu。乙同学认为该方案不合理,欲证明甲同学的结论,还需要增加对比实验,完成表中内容。
实验步骤(不要求写出具体的操作过程) | 预期现象与结论 |
________________________ | 若观察到溶液不变蓝,则证明红色固体中含有Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)羟基的电子式是______________________;
(2)(CH3CH2)2C(CH3)2的名称为___________________;
(3)2-甲基-1-丁烯的键线式__________________________;
(4)相对分子质量最小的有机物分子式_________,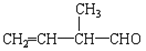 所含官能团的名称是________________;
所含官能团的名称是________________;
(5)3-甲基戊烷的一氯代产物有___________种(不考虑立体异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数的值,下列说法正确的是
A.反应 5NH4NO3=2HNO3+4N2↑+9H2O,生成22.4L N2 时转移的电子数为3.75NA
B.标准状况下甲烷和氧气的混合气体共22.4L,完全燃烧后的物质的分子总数一定为NA
C.将1mol Cl2通入水中,则 N(HClO)+N(Cl-)+N(ClO-)=2NA(N表示粒子数)
D.10g的D2O中含有的质子数与中子数分别为5NA 和4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com