
| A. |  | B. |  | C. | 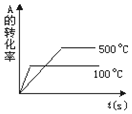 | D. | 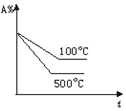 |
分析 可逆反应A(g)+2B(g)?2C(g)(正反应吸热),则升高温度反应速率加快,平衡正向移动,正反应速率大于逆反应速率,以此来解答.
解答 解:A.交叉点后升高温度,逆反应速率大于正反应速率,则正反应为放热反应,与反应不符,故A不选;
B.平衡后升高温度,逆反应速率大于正反应速率,则正反应为放热反应,与反应不符,故B不选;
C.图中温度高的反应速率应快,故C不选;
D.图中温度高反应速率快,且A的含量减小,升高温度平衡正向移动,与反应一致,故D选;
故选D.
点评 本题考查化学平衡的影响因素,为高频考点,把握温度对反应的影响及图象分析为解答的关键,侧重分析与应用能力的考查,注意反应的特点及热效应,题目难度不大.


科目:高中化学 来源: 题型:解答题
 据报道,一定条件下 Fe2O3可被甲烷还原为“纳米级”的金属铁.其反应为:Fe2O3(s)+3CH4(g)?2Fe(s)+3CO(g)+6H2(g)
据报道,一定条件下 Fe2O3可被甲烷还原为“纳米级”的金属铁.其反应为:Fe2O3(s)+3CH4(g)?2Fe(s)+3CO(g)+6H2(g)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:25℃时Ksp(BaSO4)=1.0×10-10.该温度下,CaSO4悬浊液中,c(Ca2+)与c(SO42-)的关系如图所示,下列叙述正确的是( )
已知:25℃时Ksp(BaSO4)=1.0×10-10.该温度下,CaSO4悬浊液中,c(Ca2+)与c(SO42-)的关系如图所示,下列叙述正确的是( )| A. | 向a点的溶液中加入等物质的量固体Na2SO4或Ca(NO3)2,析出的沉淀量不同 | |
| B. | a、b、c、d四点对应的体系中,d点体系最稳定 | |
| C. | 升高温度后,溶液可能会由a点转化为b点 | |
| D. | 反应Ba2+(aq)+CaSO4(s)?BaSO4(s)+Ca2+(aq)的平衡常数K=9×104 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
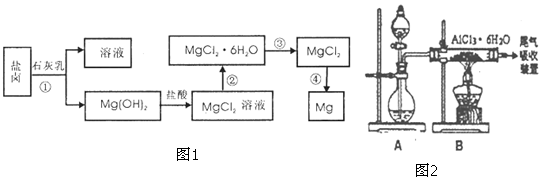
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B的单质在自然界只有一种核素 | |
| B. | 元素C、D、E的简单离子的半径依次减小 | |
| C. | A、E分别与C形成的化合物中含有一种相同类型的化学键 | |
| D. | 这几种元素可能形成的简单离子中E的简单离子的还原性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA | |
| B. | 50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA | |
| C. | 7.80 g Na2O2与5.85 g NaCl所含阴离子数相等 | |
| D. | 常温常压下,18g H2O含有的氢原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是一个电化学过程的示意图,请按要求回答下列问题
如图是一个电化学过程的示意图,请按要求回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com