
����Ŀ����ʯ���ѽ�õ���2����ϩ����һ������Ϊԭ��ͨ��ͼʾ�ϳɸ߷��ӻ�����I��
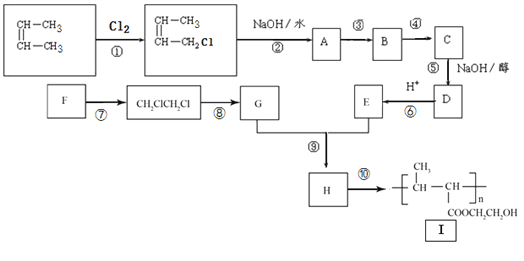
��֪����Ӧ�ۢ�����һ����Ӧ����HCl�ӳɵķ�Ӧ
�ش��������⣺
��1����Ӧ�ٵķ�Ӧ����___________��������ȥ��Ӧ����________(�����)
��2��B�Ľṹ��ʽ__________________________��E�еĹ����ŵ�����Ϊ_________
��3��д�����з�Ӧ�Ļ�ѧ����ʽ��ע����Ӧ����
��Ӧ��____________________________________________________��
��Ӧ��____________________________________________________
��4��E��ͬϵ���ͨʽΪ_________;E���������������ӳɷ�Ӧ����ӳɺ�IJ����ж���ͬ���칹�壬���к�-CHO��-OH���ֹ����ſ��ܵĽṹ����___________�֣������������칹����д�����д�֧����ͬ���칹��Ľṹ��ʽ_______________��
���𰸡� ���� ��  ̼̼˫�� �Ȼ�
̼̼˫�� �Ȼ� 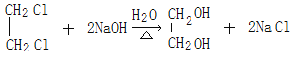 ȡ����Ӧ����ˮ�ⷴӦ��
ȡ����Ӧ����ˮ�ⷴӦ�� ![]()
ȡ����Ӧ��������Ӧ�� CnH2n-2O2 5 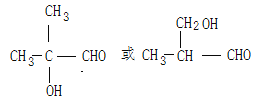
����������1����Ӧ���Ǽ�����ԭ�ӱ���ԭ��ȡ������Ҫ�ڹ��������½��С���Ӧ����±������ˮ�ⷴӦ����A�Ľṹ��ʽΪCH3CH=CHCH2OH������I�Ľṹ��ʽ��֪H�����Ӿ۷�Ӧ����I����H�Ľṹ��ʽΪCH3CH=CHCOOCH2CH2OH��E��G����������Ӧ����H������G��HOCH2CH2OH����F����ϩ��E��CH3CH=CHCOOH��D�ữ����E����D�Ľṹ��ʽΪCH3CH=CHCOONa��C���������ƵĴ���Һ�з�����ȥ��Ӧ����D������Ϊ��Ӧ�ۢ�����һ����Ӧ����HCl�ӳɵķ�Ӧ����̼̼˫�����ǻ����ܱ��������������ȷ����ӳɷ�Ӧ��Ȼ���������ǻ�������Ӧ���Ǽӳɷ�Ӧ��B�Ľṹ��ʽΪCH3CH2CHClCH2OH��CH3CHClCH2CH2OH����Ӧ����������Ӧ��C�Ľṹ��ʽΪCH3CH2CHClCOOH��CH3CHClCH2COOH���������Ϸ�����֪������ȥ��Ӧ���Ǣݣ���2��B�Ľṹ��ʽΪCH3CH2CHClCH2OH��CH3CHClCH2CH2OH��E��CH3CH=CHCOOH��E�еĹ����ŵ�����Ϊ̼̼˫�����Ȼ�����3����Ӧ����±������ˮ�ⷴӦ������ʽΪ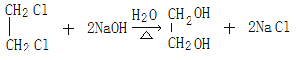 ����Ӧ����������Ӧ������ʽΪ
����Ӧ����������Ӧ������ʽΪ![]() ����4��E��CH3CH=CHCOOH�������к���1��̼̼˫�������E��ͬϵ���ͨʽΪCnH2n-2O2��E���������������ӳɷ�Ӧ����ӳɺ�IJ����ж���ͬ���칹�壬���к�-CHO��-OH���ֹ����ſ��ܵĽṹ��HOCH2CH2CH2CHO��CH3CHOHCH2CHO��CH3CH2CHOHCHO��(CH3)2COHCHO��HOCH2CH(CH3)CHO���ϼ���5�������д�֧����ͬ���칹��Ľṹ��ʽΪ(CH3)2COHCHO��HOCH2CH(CH3)CHO��
����4��E��CH3CH=CHCOOH�������к���1��̼̼˫�������E��ͬϵ���ͨʽΪCnH2n-2O2��E���������������ӳɷ�Ӧ����ӳɺ�IJ����ж���ͬ���칹�壬���к�-CHO��-OH���ֹ����ſ��ܵĽṹ��HOCH2CH2CH2CHO��CH3CHOHCH2CHO��CH3CH2CHOHCHO��(CH3)2COHCHO��HOCH2CH(CH3)CHO���ϼ���5�������д�֧����ͬ���칹��Ľṹ��ʽΪ(CH3)2COHCHO��HOCH2CH(CH3)CHO��


 ��ǰ����ϵ�д�
��ǰ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ijѧУʵ���Ҵӻ�ѧ�Լ��̵���ص������Լ���ǩ�ϵIJ������ݣ����ø���������0.2 mol/L��ϡ���ᡣ�ɹ�ѡ�õ������У�

�ٽ�ͷ�ιܣ� ����ƿ�� ���ձ��� ��ҩ�ף� ����Ͳ�� ��������ƽ���߲������� ������ƿ�� ��ش��������⣺
��1�� ����ϡ����ʱ�����������в���Ҫ�õ�����__________��ѡ����ţ���
��2������������ʵ���Ũ��Ϊ________________________________��
��3����ʵ��������Ҫ�õ�475mL0.2mol/L��ϡ���ᣬ����ʵ�����ƹ�����ʵ����Ա������Ͳ��ȡ��������____________________mL��
��4�����в�����ʹ�����Ƶ���ҺŨ��ƫ�͵���__________________��������ţ�
A����ȡ����ʱ�����ӿ̶���
B������ʱ����������ƿ�̶���
C������ǰ������ƿ����ˮ��
D�����ݺ�ҡ�ȷ���Һ���½����������м�ˮ���̶���
E���ܽ�����ʱ�ձ��е���Һδ��ȴ�����£���ת��������ƿ�м�ˮ���ݡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ҫ��ش����⣺

(1)���Ȼ�����Һ�еõ��Ȼ��ع��壬ѡ��װ�D_________(�����װ�ø����ĸ����ͬ��;��ȥ����ˮ��Cl-�����ʣ�ѡ��װ��______________��
(2)����ˮ������з����ֲ���ͣ�ѡ��װ��_________���÷��뷽��������Ϊ___________��
(3)װ��A�Тٵ�������_________����ˮ�ķ����Ǵ�_______�ڽ�ˮ��װ��B�ڷ�Һʱ�������²�Һ���_______���ϲ�Һ���_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ�������
�ٳ����£�ǿ����Һ��pH=a������Һ�����ϡ�͵�ԭ��10n������pH=a+n��
����֪BaSO4��Ksp=c��Ba2+��c��SO42������������BaSO4��Һ����c��Ba2+��=c��SO42����=![]()
�۽�0.1molL��1��NaHS��0.1molL��1 Na2S��Һ�������ϣ�������Һ����c��S2����+2c��OH����=2c��H+��+c��HS����+3c��H2S��
����0.1mol/L����������Һ�еμ�0.1mol/L���ᣬ�պ���ȫ�к�ʱpH=a������ˮ���������c(H+)=10��amolL��1��
A. �٢ڢۢ� B. ֻ�Тڢ� C. ֻ�Тۢ� D. ֻ�Т�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪0.05molij���������Ŀ�������ȫȼ����������ͨ�������ij���ʯ��ˮ���õ���ɫ����30.0g���������ļ�ʯ������ȼ�ղ������18.6g���������ʵ��ʽΪ___________��;����ʽΪ_______;
����������������̼ԭ�Ӷ���һ��ƽ���ϣ���ṹ��ʽΪ________________________
��2��ij�л��ᆳ���ϣ��������������֪����Է�������Ϊ136������ʽC8H8O2��������ֻ��һ�������ұ�����ֻ��һ��ȡ��������˴Ź���������ͼ����A���ܵĽṹ��ʽ_____________________

��3��ij���ĺ���������������С��150�����к���Ԫ�ص���������Ϊ50%����������е���ԭ�Ӹ�������Ϊ____________������ԭ�������ĸ��л���ķ���ʽΪ____________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£��ں����ܱ������У��ܱ�ʾ��ӦX(g)��2Y(g) ![]() 2Z(g)һ���ﵽ��ѧƽ��״̬����(����)
2Z(g)һ���ﵽ��ѧƽ��״̬����(����)
��X��Y��Z�����ʵ���֮��Ϊ1��2��2
��X��Y��Z��Ũ�Ȳ��ٷ����仯
�������е�ѹǿ���ٷ����仯
�ܵ�λʱ��������n mol Z��ͬʱ����2n mol Y
A. �٢� B. �٢� C. �ڢ� D. �ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˼���FeCl2��Һ�Ƿ���ʣ�Ӧѡ�������Լ��еģ� ��
A.����B.BaCl2��ҺC.KSCN��ҺD.ʯ����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼�������仯����������������ء������Ҫ��ش���������:
(1)��CH4����ԭ��������������������������Ⱦ����֪:
��CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ��H= ��574kJ/mol
��CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ��H= ��1160kJ/mol
��H2O(g)=H2O(l) ��H= ��44kJ/mol
д��CH4(g)��NO2(g)��Ӧ����N2(g)��CO2(g)��H2O(1)���Ȼ�ѧ����ʽ_________��
(2)��֪:��ӦI:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) ��H<0
4NO(g)+6H2O(g) ��H<0
��ӦII:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ��H<0
2N2(g)+6H2O(g) ��H<0
���ں��º���װ���г���һ������NH3��O2,�ڴ����������½��з�ӦI���������й���������ȷ����___(����ĸ���)��
A.����ѹǿ��Kp(��ѹǿ��ʾ�Ļ�ѧƽ�ⳣ��)����
B.�����������3v(NH3)=2v (H2O)ʱ��˵����Ӧ�Ѵ�ƽ��
C.ͨ��һ�����ĵ�������ѧ��Ӧ��������
D.�ﵽƽ��ʱ��ϵ��ѹǿ���ٱ仯
�ڰ�������ʱ�ᷢ����������������ӦI��II��Ϊ����ij�����Ը÷�Ӧ��ѡ���ԣ���1L�ܱ������г���1molNH3��2molO2�����й����ʵ�����ϵ��ͼ���ô����ڵ���ʱѡ��Ӧ_____(�I����II��)��
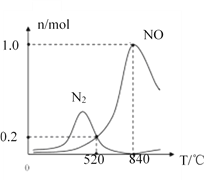
��520��ʱ��4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g)��ƽ�ⳣ��K=_______(ֻ���г����ּ���ʽ�����軯��)����ѹ�����У�Ϊ�����NH3ת��ΪN2ƽ��ת���ʵĴ�ʩ��______(����ĸ���)
2N2(g)+6H2O(g)��ƽ�ⳣ��K=_______(ֻ���г����ּ���ʽ�����軯��)����ѹ�����У�Ϊ�����NH3ת��ΪN2ƽ��ת���ʵĴ�ʩ��______(����ĸ���)
A.���ͷ�Ӧ�¶� B. Ͷ�ϱȲ��䣬���ӷ�Ӧ���Ũ��
C.����NH3��O2�ij�ʼͶ�ϱ� D. ����һ�����ĺ���
��3����֪25��ʱHCN��H2CO3�ĵ��볣��(Ka.)���±�:
���� | ���볣��(Ka) |
HCN | Ka=5��10-10 |
H2CO3 | Ka1=4.5��10-7��Ka2=4.7��10-11 |
25��ʱ����õ������Ũ�ȵ�HCN��NaCN�Ļ����ҺpH=11,��c(Na+)��c(H+)��c(CN��)��c(OH��)��c(HCN)Ũ���ɴ�С˳��Ϊ______����NaCN��Һ��ͨ������CO2��������Ӧ�Ļ�ѧ����ʽΪ:______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ĿǰӦ����㷺�Ľ������ϣ��˽������ʴ��ԭ�����������������Ҫ���壬�Ը�����Ʒ���п���ʴ���������ʵ��ӳ���ʹ��������
��1������ʴ����ǰ�������г��������������⡣�ֽ�һ����������������������У��������������Һ�з����Ļ��Ϸ�Ӧ�Ļ�ѧ����ʽΪ��________________________��
��2��������ͼװ�ã�����ģ�����ĵ绯ѧ������
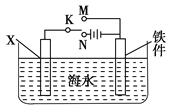
�ٿ���K�Ͽ�ʱ������Ϊ��������������Ҫ����_____��ʴ����XΪ̼����Ϊ���������ĸ�ʴ������KӦ����________����
����XΪп������K����M�����õ绯ѧ��������Ϊ________��
��3����ͼ����XΪ��ͭ����п�����ʣ��������к�ˮ�滻Ϊ����ͭ��Һ������K����N����һ��ʱ���������������127 gʱ��X�缫�ܽ��ͭ������________127 g(����<����>����������)�����������ͭ����Ч��ֹ������ʴ�������������δ����ͭ����Ʋ����𣬶�ͭ���ȶ�п���������ױ���ʴ�����Ҫ˵��ԭ��__________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com