
[化学------选修3:物质结构与性质]
M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题:
(1)R基态原子的电子排布式是 ,X和Y中电负性较大的是 (填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是___________。
(3)X与M形成的XM3分子的空间构型是__________。
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如图所示,
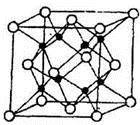
则图中黑球代表的离子是_________(填离子符号),该离子的配位数为 。该晶胞参数a="b=c=d" pm ,列式计算R2M晶体的密度为 g/cm³。
(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是__________。
 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源:2016-2017学年广东省高一上大考二化学卷(解析版) 题型:填空题
Ⅰ.写出碳酸氢钠和次氯酸在水溶液中的电离方程式 、 。
Ⅱ.某无色透明溶液中可能大量存在Ag+、Al3+、Cu2+、Fe3+、Na+中的几种,回答下列问题:
(1)不做任何实验就可以肯定原溶液中不存在的离子是___________。
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是_______________。
(3)取(2)中的滤液,加入过量的稀氨水(NH3·H2O),出现白色沉淀,说明原溶液中肯定有___________,有关的离子方程式为______________________。
(4)原溶液可能大量存在的阴离子是下列的___________。
A.Cl- B.NO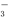
C.CO D.OH-
D.OH-
(5)请设计实验证明原溶液中有钠离子(写出详细实验操作过程及现象) __________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高一12月月考化学试卷(解析版) 题型:选择题
a g Mg、Al合金完全溶解在C1 mol·L-1、V1L HCl溶液中,产生bmolH2。再向反应后的溶液中加入C2 mol·L-1、V2 L NaOH溶液,恰好使沉淀达到最大值,且沉淀质量为d g。下列关系错误的是( )
A.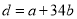 B.C1=C2V2/V1
B.C1=C2V2/V1
C.铝为 (12b-a)/9 mol D.与金属反应后剩余盐酸为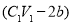 mol
mol
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上月考四化学试卷(解析版) 题型:填空题
【化学——选修3:物质结构与性质】
请回答下列问题:
(1)写出硅原子基态时的核外电子排布式:______________。硅元素位于元素周期表的第_________族。
(2)从晶体类型来看,金刚石属于_________晶体。
(3)甲烷分子中碳原子的杂化方式为________。SO42-的空间构型为_______________。
(4)实验测定HF的相对分子质量时,实验测定值一般高于理论值的原因是______________。
(5)NaCl和CsCl熔点高的是 ,(填化学式)其主要原因是 。
(6)CaF2晶胞结构如图所示,该晶体的密度为a g/cm3,则晶胞的体积是 (只要求列出算式)。
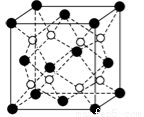
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上月考四化学卷(解析版) 题型:选择题
下列说法不正确的是( )
A.两种不溶物的Ksp相差越大,不溶物就越容易转化为更难溶的不溶物
B.常温下,浓度均为0.1mol/L①醋酸、②盐酸、③醋酸钠溶液,水电离程度的顺序为③>①>②
C.常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为酸性
D.物质的浓度相同的①氯化铵溶液、②硫酸铵溶液、③碳酸氢铵溶液,pH的顺序为:③>①>②
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三12月月考化学试卷(解析版) 题型:填空题
数十年来,化学工作者对碳的氧化物做了广 泛深入的研究并取得了一些重要成果。如利用CO2和CH4重整可制合成气(主要成分为CO、H2),已知重整过程中部分反应的热化学方程式为:
泛深入的研究并取得了一些重要成果。如利用CO2和CH4重整可制合成气(主要成分为CO、H2),已知重整过程中部分反应的热化学方程式为:
I.CH4(g)=C(s)+2H2(g) ΔH= + 75.0 kJ·mol-1
II.CO2(g)+H2(g)=CO(g)+H2O(g) ΔH = + 41.0 kJ·mol-1
III.CO(g)+H2(g)=C(s)+H2O(g) ΔH = -131.0 kJ·mol-1
(1)反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的ΔH = kJ·mol-1。
(2)固定n(CO2)=n(CH4),改变反应温度,CO2和CH4的平衡转化率见图甲。
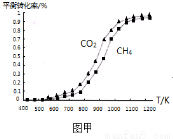
同温度下CO2的平衡转化率 (填“大于”或“小于”)CH4的平衡转化率,其原因是 。
②高温下进行该反应时常会因反应I生成“积碳”(碳单质),造成催化剂中毒,高温下反应I能自发进行的原因是 。
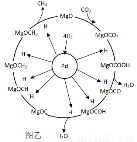
(3)一定条件下Pd-Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如图乙所示,该反应的化学方程式为 。
(4)CO常用于工业冶炼金属,右图是在不同温度下CO还原四种金属氧化物达平衡后气体中lg[c(CO)/c(CO2)]与温度(t)的关系曲线图。下列说法正确的是 。(填序号)
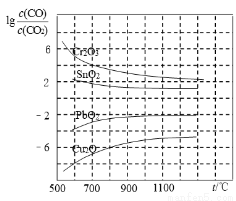
A.工业上可以通过增高反应装置来延长矿石和CO接触的时间,减少尾气中CO的含量
B.CO不适宜用于工业冶炼金属铬(Cr)
C.工业冶炼金属铜(Cu)时较低的温度有利于提高CO的利用率
D.CO还原PbO2的反应ΔH>0
(5)在载人航天 器中应用电化学原理,以Pt为阳极,Pb(CO2的载体)为阴极,KHCO3溶液为电解质溶液,还原消除航天器内CO2同时产生O2和新的能源CO,总反应的化学方程式为:
器中应用电化学原理,以Pt为阳极,Pb(CO2的载体)为阴极,KHCO3溶液为电解质溶液,还原消除航天器内CO2同时产生O2和新的能源CO,总反应的化学方程式为: 2CO2
2CO2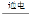 2CO+O2,则其阳极的电极反应式为 。
2CO+O2,则其阳极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三12月月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.碳酸钠溶液呈碱性,可用于治疗胃酸过多
B.浓度相同的NaNO3溶液和HNO3溶液中NO3-化学性质不同
C.钠的金属性比钾强,工业上用钠制取钾(Na+KCl K↑+NaCl)
K↑+NaCl)
D.既有单质参加,又有单质生成的反应一定是氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一上月考二化学卷(解析版) 题型:选择题
NaNO2是一种食品添加剂,它能致癌。酸性 KMnO4溶液与 NaNO2的反应方程式是MnO4- + NO2- + □ → Mn2+ + NO3- + H2O。下列叙述中正确的是( )
A.该反应中NO2?被还原
B.反应过程中溶液的pH减小
C.生成1molNaNO3需消耗0.4molKMnO4
D.□中的粒子是OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com