
| A. | 钠的硬度大于铝 | B. | 镁的熔沸点高于钙 | ||
| C. | 镁的硬度大于钾 | D. | 钙的熔沸点高于钾 |
分析 根据金属原子半径越小,价电子数越多,则金属键越强,判断金属键的强弱,金属键越强其金属的硬度越大,熔沸点越高.
解答 解:A.铝的原子半径比钠小,价电子数比钠多2个,因此铝的金属键较强,硬度较大,故A错误;
B.镁原子半径小于钙原子,价电子数相等,因此镁的金属键较强,镁的熔沸点高于钙,故B正确;
C.镁原子半径小于钾,价电子数比钾多,因此镁的金属键较强,镁的硬度大于钾,故C正确;
D.钙原子半径小于钾,价电子数比钾多,因此钙的金属键较强,钙的熔沸点高于钾,故D正确.
故选:A.
点评 本题考查了金属键强弱的判定方法,难度不大,抓住金属原子半径越小,价电子数越多,则金属键越强是关键.


科目:高中化学 来源: 题型:解答题
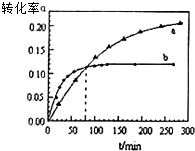 丙酮(CH3COCH3)可作为合成聚异戊二烯橡胶,环氧树脂等物质的重要原料,丙酮在某溶剂里在催化剂作用下发生反应:2CH3COCH3(aq)?CH3COCH2COH(CH3)2(aq).回答下列问题
丙酮(CH3COCH3)可作为合成聚异戊二烯橡胶,环氧树脂等物质的重要原料,丙酮在某溶剂里在催化剂作用下发生反应:2CH3COCH3(aq)?CH3COCH2COH(CH3)2(aq).回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:解答题
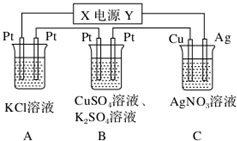
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4 | B. | KAl(SO4)2 | C. | NaHCO3 | D. | CH3COONa |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 保持容器的体积不变充入1molHe | ||
| C. | 将水蒸气从体系中分离出 | D. | 增大容器容积,减小压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
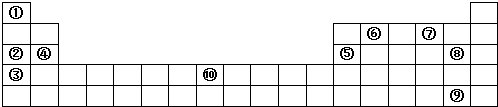
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| A | B | C | D | E | F | |
| A | ↑↓ | - | - | ↓ | - | |
| B | ↑↓ | ↓ | - | ↓ | ↓ | |
| C | - | ↓ | - | - | ↓ | |
| D | - | - | - | ↓ | - | |
| E | ↓ | ↓ | - | ↓ | ↓ | |
| F | - | ↓ | ↓ | - | ↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com