
分析 将饱和FeCl3溶液滴入沸水中,Fe3+会水解为氢氧化铁胶体;胶体和溶液的本质区别是分散质粒子直径的大小;胶体的特征反应为丁达尔效应;胶体有吸附功能;除去胶体中的小离子,用渗析的方法.据此分析.
解答 解:将饱和FeCl3溶液滴入沸水中,Fe3+会水解为红褐色的氢氧化铁胶体;胶体和溶液的本质区别是分散质粒子直径的大小;胶体的特征反应为丁达尔效应,而溶液没有,故两者可以用丁达尔效应来区分;胶粒有吸附功能,故可用于净水;胶粒不能透过半透膜,而小分子和小离子可以透过,故除去胶体中的小离子用渗析的方法.故答案为:红褐色;氢氧化铁胶体;分散质粒子直径的大小;丁达尔;胶粒有吸附功能;渗析.
点评 本题考查了胶体的制备、和其它分散系的本质区别以及其特有的性质,难度不大,掌握基础是关键.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应过程中MnO2作催化剂 | B. | 盐酸未反应完 | ||
| C. | 被还原的HCl少于0.2mol | D. | 反应产生2.24L氯气(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C+H2O$\frac{\underline{\;高温\;}}{\;}$ CO+H2 | B. | 2K+2H2O═2KOH+H2↑ | ||
| C. | 2F2+2H2O═4HF+O2 | D. | 2Na2O2+2H2O═4NaOH+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2S既是氧化产物又是还原产物 | |
| B. | FeS2既作氧化剂,又作还原剂 | |
| C. | 5 mol FeS2发生反应,有21 mol电子转移 | |
| D. | 产物中的SO42-有一部分是氧化产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 +3NaOH$\stackrel{水}{→}$
+3NaOH$\stackrel{水}{→}$ +CH3COONa+2H2O
+CH3COONa+2H2O

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
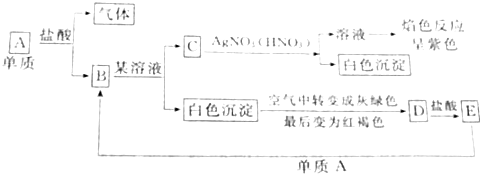 根据图示填空:
根据图示填空:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com