
| 实验步骤 | 现象 | 结论 | |
| A | 取待测液,滴加酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色 | 待测液中可能含Fe2+ |
| B | 将待测气体通入品红溶液中,稍后加热溶液 | 开始品红溶液褪色,加热后又变为红色 | 待测气体中肯定含SO2 |
| C | 取待测液,滴加硝酸酸化的 BaCl2溶液 | 生成白色沉淀 | 待测液中可能含Ag+ |
| D | 将湿润的KI淀粉试纸较长时间置于待测气体中 | 取出后没有观察到试纸变色 | 待测气体中肯定不含Cl2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.具有还原性的离子均可被高锰酸钾氧化;
B.品红与有色物质化合生成无色物质,不稳定;
C.白色沉淀可能为AgCl;
D.长时间碘单质被氧化为碘酸.
解答 解:A.具有还原性的离子均可被高锰酸钾氧化,则待测液中可能含Fe2+,故A正确;
B.品红与有色物质化合生成无色物质,不稳定,则加热后又变为红色,待测气体中肯定含SO2,故B正确;
C.白色沉淀可能为AgCl,则待测液中可能含Ag+,故C正确;
D.可能含有氯气,长时间碘单质被氧化为碘酸,所以没有观察到试纸变色,故D错误;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应与现象、离子及物质检验为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度中等.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:选择题
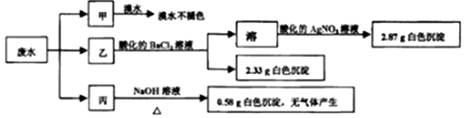
| A. | 废水可能含有Na+、K+、Fe3+ | |
| B. | 可能存在的离子用焰色反应进一步检验确认 | |
| C. | 废水一定含有Cl-、SO42-和Mg2+,且c(Cl-)=0.2mol•L-1 | |
| D. | 废水一定不含 SO32-、Cl-、NH4+、Na+、K+、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 装置和试剂 | 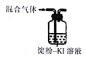 | 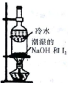 | 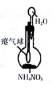 |  |
| 实验目的 | 检验NO2中混有溴蒸汽 | 分离潮湿的NaOH和I2 | 验证NH4NO3溶解吸热 | 制备和收集SO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 棉花、羊毛、丝绸的主要成分均为蛋白质 | |
| B. | 丙烷中的3个碳原子一定在同一平面上 | |
| C. | 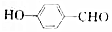 中含有的官能团有3种 中含有的官能团有3种 | |
| D. | 乙烯使溴水和酸性KMnO4溶液褪色的原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 数据编号 | 滴入NaOH的体积/mL | 溶液的pH | |
| HX | HY | ||
| ① | 0 | 3 | 1 |
| ② | a | 7 | x |
| ③ | 20.00 | >7 | y |
| A. | 在相同温度下,同浓度的两种酸溶液的导电能力:HX<HY | |
| B. | 由表中数据可估计出Ka(HX)≈10-5 | |
| C. | HY和HX混合,c(H+)=c(X-)+c(Y-)+c(OH-) | |
| D. | 上述反应后的HY溶液中:c(Na+)>c(Y-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
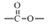 结构
结构 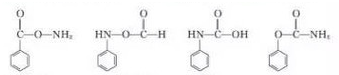 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升温,逆反应速率减小 | B. | 加压,H2浓度减小 | ||
| C. | 增加H2,K减小 | D. | 该反应的正反应是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
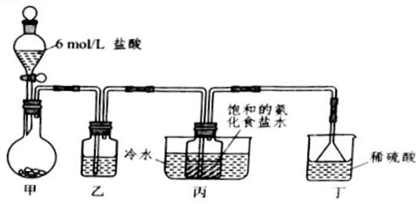
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com