
| A�� | 1L 0.1mol•L-1��NaHCO3��Һ��HCO3-��CO32-������֮��Ϊ0.1NA | |
| B�� | 50ml 12mol/L����������MnO2���ȣ�ת�Ƶĵ�����Ϊ0.3NA | |
| C�� | ����������CO2��Ӧʱ������0.1mol����ת�Ƶĵ�����Ϊ0.2NA | |
| D�� | �ܱ�������2molNO��1molO2��ַ�Ӧ������ķ�����Ϊ2NA |
���� A��HCO3-����Һ�м��ܵ�������ˮ�⣻
B����������ֻ����Ũ���ᷴӦ����ϡ�����Ӧ��
C�����������������̼��Ӧʱ����Ԫ�ط����绯��Ӧ��
D��2molNO��1molO2��ַ�Ӧ����NO2����NO2����ƽ�⣺2NO2?N2O4��
��� �⣺A��HCO3-����Һ�м��ܵ���ΪCO32-����ˮ��ΪH2CO3�����������غ��֪����1L 0.1mol•L-1��NaHCO3��Һ��H2CO3��HCO3-��CO32-������֮��Ϊ0.1NA����A����
B����������ֻ����Ũ���ᷴӦ����ϡ�����Ӧ��������ܷ�Ӧ��ȫ����ת�Ƶĵ�����С��0.3NA������B����
C�����������������̼��Ӧʱ����Ԫ�ط����绯��Ӧ��������-1�۱�Ϊ0�ۣ��ʵ�����0.1mol����ʱת��0.2mol���Ӽ�0.2NA������C��ȷ��
D��2molNO��1molO2��ַ�Ӧ����2molNO2����NO2����ƽ�⣺2NO2?N2O4�����·�������С���ʲ���ķ�����С��2NA������D����
��ѡC��
���� ���⿼���˰���٤���������йؼ��㣬�������չ�ʽ��ʹ�ú����ʵĽṹ�ǽ���ؼ����ѶȲ���


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
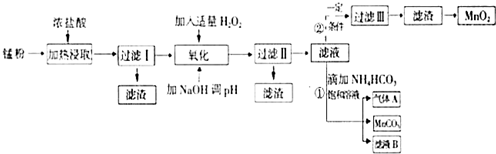 ����������صĻ������⣬�����Ϊ�����ǻ�ѧ��չ��һ����Ҫ���������÷Ͼ�����п�̸ɵ�ؾ��������̷�[��MnO2��MnO��OH����Zn��NH3��2Cl2��Fe��NH4Cl��̿�ڵ�]��ȡMnO2�������ܴ��Բ���̼���̣�MnCO3��������������ͼ��ʾ��
����������صĻ������⣬�����Ϊ�����ǻ�ѧ��չ��һ����Ҫ���������÷Ͼ�����п�̸ɵ�ؾ��������̷�[��MnO2��MnO��OH����Zn��NH3��2Cl2��Fe��NH4Cl��̿�ڵ�]��ȡMnO2�������ܴ��Բ���̼���̣�MnCO3��������������ͼ��ʾ��| ������ | Fe��OH��2 | Fe��OH��3 | Mn��OH��2 | Zn��OH��2 |
| ������ʼʱPH | 7.5 | 2.2 | 8.8 | 6.5 |
| ������ȫʱPH | 9.5 | 3.7 | 10.8 | 8.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������Ż�ʱ��������ˮ���� | |
| B�� | ��������й©ʱ��Ѹ���뿪�ֳ������������ߴ�ȥ | |
| C�� | ���������ľƾ��������Ż�ʱ�������ô���ˮ���� | |
| D�� | ����Ũ����մ��Ƥ���ϣ������ô�������������Һ��ϴ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
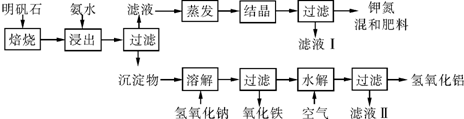
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ʵ�� | ʵ��Ŀ�� |
| A���ⶨ�����ʵ���Ũ�ȵ� CH3COONa��Na2S��ҺpH | �Ƚ� CH3COOH��H2S������ǿ�� |
B��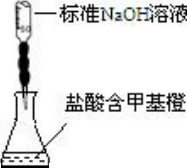 | �ⶨ�����Ũ�� |
C��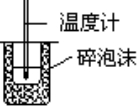 | �ⶨ�к��� |
| D�����÷�̪�����ü�����ָʾ�����ñ�����ζ�0.1 mol/L��Na2CO3��Һ | ֤�� CO32-ˮ������� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
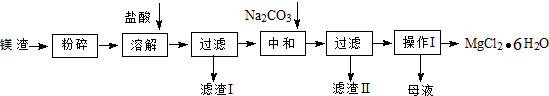
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �մɡ�������ˮ������������������� | |
| B�� | �����������Σ������ڼ���Թ����ƿ��Ա�����ĥ�ڲ��������Լ�ƿ�� | |
| C�� | ��SiO2��ȡ���ᣬӦ��ʹ��������������������Һ��Ӧ��Ȼ����ͨ��CO2 | |
| D�� | ��Na2CO3+SiO2 $\frac{\underline{\;����\;}}{\;}$CO2+Na2SiO3��֪��������Դ���̼�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������ռ���Һ��Ӧ��Cl2+2OH-�TCl-+ClO-+H2O | |
| B�� | ����������ϡ���ᷴӦ��FeO+3H+�TFe3++H2O | |
| C�� | �Ȼ�������Һ��ͨ��������2Fe2++Cl2�T2Fe3++2 Cl- | |
| D�� | ��������ˮ��Ӧ��2Na+2H2O�T2 Na++2OH-+H2�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com