
| A. | N | B. | F | C. | Na | D. | Al |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
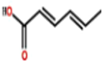
| A. | 该有机物与等物质的量Br2发生加成反应时,可生成两种加成产物 | |
| B. | 该有机物能与金属Na、NaOH溶液、Na2CO3溶液、NaHCO3溶液发生反应 | |
| C. | 该有机物能发生加成、取代、氧化、消去、加聚反应 | |
| D. | 可使用酸性高锰酸钾溶液鉴别该有机物和乳酸(2-羟基丙酸) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
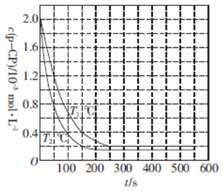
| A. | T1<T2 | |
| B. | p-CP降解反应是吸热反应 | |
| C. | 其他条件相同时,温度越高,反应速率越快 | |
| D. | T1℃时,在50〜150 s之间p-CP的平均降解速率为1.6×10-5 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入浓盐酸 | B. | 加入一定量CuSO4固体 | ||
| C. | 加入适量的水 | D. | 降低温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N3-与CO2 | B. | BF3和C O32- | C. | NO2+与CO2 | D. | H3O+与NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com