
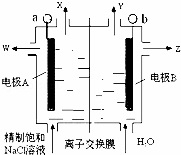
如图是氯碱工业中应用的立式隔膜电解槽示意图,其中的离子膜仅允许阳离子通过.下列说法正确的是( )
|
| A. | 加入的H2O可用稀NaCl溶液代替,以增加导电能力 |
|
| B. | W是稀的氯化钠溶液 |
|
| C. | OH﹣从阴极区向阳极区移动 |
|
| D. | b电极反应式:2Cl﹣﹣2e﹣=Cl2↑ |
| 原电池和电解池的工作原理. | |
| 专题: | 电化学专题. |
| 分析: | 电解食盐水时,阳极发生氧化反应,消耗NaCl,则应在阳极补充NaCl,左侧应为电解池的阳极区,右侧应为电解池的阴极区,电解时,阳离子经过离子交换膜向阴极区移动. |
| 解答: | 解:电解食盐水时,阳极发生氧化反应,消耗NaCl,则应在阳极补充NaCl,左侧应为电解池的阳极区,右侧应为电解池的阴极区, A.如果加入的H2O可用稀NaCl溶液代替,虽然能增加导电能力,但Z处得不到纯净的NaOH溶液,故A错误; B.a电极上氯离子放电生成氯气,钠离子通过交换膜进入阴极区,所以W得到的是稀的NaCl溶液,故B正确; C.该离子交换膜只能阳离子通过,阴离子不能通过,所以OH﹣不能从阴极区向阳极区移动,故C错误; D.a电极反应式:2Cl﹣﹣2e﹣=Cl2↑、b电极反应式为2H2O+2e﹣=H2↑+2OH﹣,故D错误; 故选B. |
| 点评: | 本题考查了电解原理,正确判断阴阳极是解本题关键,根据加入物质确定阴阳极,知道离子交换膜特点,易错选项是A. |


 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:
Ⅰ.钢铁工业是国家工业的基础。请回答在钢铁腐蚀、防护过程中的有关问题。
(1)请写出钢铁在碱性、潮湿的环境下发生电化学腐蚀正极的电极反应式:
;
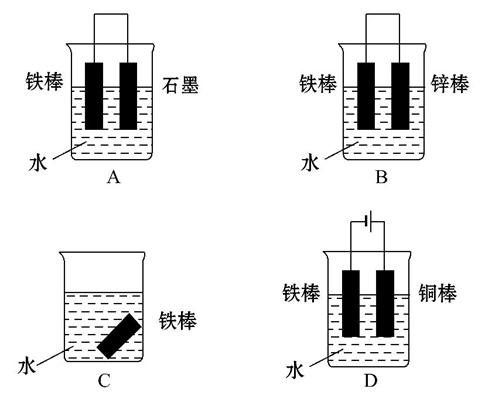
(2)下列哪个装置示意图可防止铁棒被腐蚀 。
Ⅱ.某小组为研究电化学原理,设计如图装置。请回答下列问题:
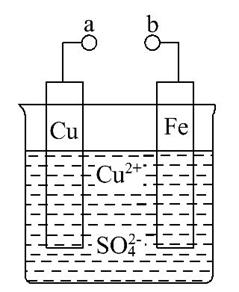
(1)a和b不连接时,铁片上发生反应的离子方程式为 ,
此时能量转化形式主要是化学能转化为 能。
(2)a和b用导线连接时,外电路中的电子是从 (填“Fe”或“Cu”)电极流出, (填“Cu2+”或“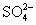 ”)向负极移动,铜极发生反应的电极反应式为 。
”)向负极移动,铜极发生反应的电极反应式为 。
(3)现在要在铁片上镀一层金属铜,则a极要和直流电源的 (填“正极”或“负极”)连接;此时铜片上发生的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
两种气态烃以一定比例混合,在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L.下列各组混合烃中不符合此条件的是( )
|
| A. | CH4 C2H4 | B. | CH4 C3H6 | C. | C2H4 C3H4 | D. | C2H2 C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃和1.01×105Pa时,反应2N2O5(g)=4NO2(g)+O2(g)△H=+56.76kJ/mol,自发进行的原因是( )
|
| A. | 是吸热反应 | B. | 是放热反应 |
|
| C. | 是熵减少的反应 | D. | 熵增大效应大于能量效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,对于A2(g)+3B2(g)⇌2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是( )
|
| A. | v(A2)=0.008 mol•L﹣1•s﹣1 | B. | v(A2)=0.3 mol•L﹣1•min﹣1 |
|
| C. | v(AB3)=0.01 mol•L﹣1•s﹣1 | D. | v(B2)=0.012 mol•L﹣1•s﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
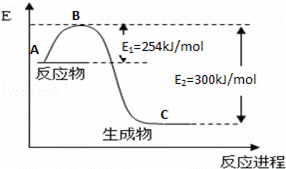
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,
(1)如图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式: ;
(2)若已知下列数据:
| 化学键 | H﹣H | N≡N |
| 键能/kJ•mol﹣1 | 435 | 943 |
试根据表中及图中数据计算N﹣H的键能 kJ•mol﹣1
(3)合成氨反应通常用铁触媒作催化剂.使用铁触媒后E1和E2的变化是:E1 ,E2 (填“增大”、“减小、”“不变”).
(4)用NH3催化还原NOX还可以消除氮氧化物的污染.例如
4NH3(g)+3O2(g)=2N2(g)+6H2O(g);△H1=akJ/mol
N2(g)+O2(g)=2NO(g);△H2=bkJ/mol
若1mol NH3还原NO至N2,则该反应过程中的反应热△H3= kJ/mol(用含a、b的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是铅蓄电池充、放电时的工作示意图,已知放电时电池反应为PbO2+Pb+
4H++2S ====2PbSO4+2H2O。下列有关说法正确的是 ( )
====2PbSO4+2H2O。下列有关说法正确的是 ( )

A.K与N相接时,能量由电能转化为化学能
B.K与N相接时,H+向负极区迁移
C.K与M相接时,所用电源的a极为负极
D.K与M相接时,阳极附近的pH逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
已知Fe3+和I-在水溶液中的反应如下:2I-+2Fe3+====I2+2Fe2+。某温度下该反应的正反应速率和I-、Fe3+浓度的关系为v=kcm(I-)·
cn(Fe3+)(k为常数)。
|
| c(I-)/mol·L-1 | c(Fe3+)/mol·L-1 | v/mol·L-1·s-1 |
| ① | 0.20 | 0.80 | 0.032 k |
| ② | 0.60 | 0.40 | 0.144 k |
| ③ | 0.80 | 0.20 | 0.128 k |
由此推知,有关Fe3+、I-的浓度对反应速率影响的判断正确的是( )
A.Fe3+浓度对正反应速率影响程度大于I-浓度的影响程度
B.Fe3+浓度对正反应速率影响程度小于I-浓度的影响程度
C.Fe3+浓度对正反应速率影响程度等于I-浓度的影响程度
D.无法比较
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com