
| A. | H2SO4溶液与NaOH溶液混合 | B. | HCl气体通入Ca(OH)2溶液中 | ||
| C. | HNO3溶液与KOH溶液混合 | D. | NH4HSO4溶液与NaOH溶液混合 |
分析 H++OH-═H2O表示强酸或者强酸的酸式根离子与强碱反应只生成可溶性盐和水的反应,据此解答.
解答 解:A.H2SO4溶液与NaOH溶液混合反应生成硫酸钠和水,反应实质是氢离子与氢氧根离子反应生成水,能用H++OH-═H2O表示,故A不选;
B.HCl气体通入Ca(OH)2溶液,反应实质是氢离子与氢氧根离子反应生成水,离子方程式为:H++OH-═H2O,故B不选;
C.HNO3溶液与KOH溶液混合,反应的实质是氢离子与氢氧根离子反应生成水,离子方程式为:H++OH-═H2O,故C不选;
D.NH4HSO4溶液与NaOH溶液混合,离子方程式为:NH4++H++2OH-═H2O+NH3•H2O,故D选;
故选D.
点评 本题考查了离子方程式的书写,明确离子方程式的意义和书写方法是解题关键,题目难度不大,侧重于考查学生的分析能力和对基础知识的应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 块状固体药品的取用:一横、二放、三慢竖 | |
| B. | 液体药品的倾倒:瓶塞倒放、紧挨瓶口、缓慢倒入 | |
| C. | 分液的操作:静置分层后将分液漏斗中下层液从下口放出,再将上层液从上口倒出 | |
| D. | 冷凝管的使用:冷却水下口进,上口出 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

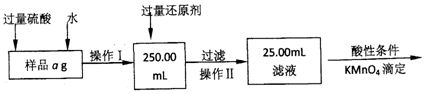
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化学键 | O═O | C≡O | C═O |
| 键能(kJ/mol) | 497 | 1072 | 803 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
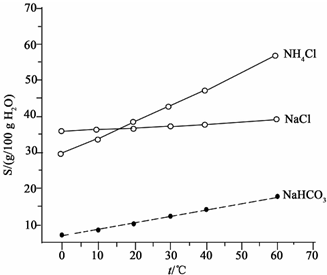
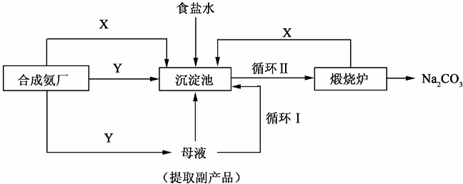
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①③⑦ | B. | 除①⑧外 | C. | 除⑥外 | D. | 只有②⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
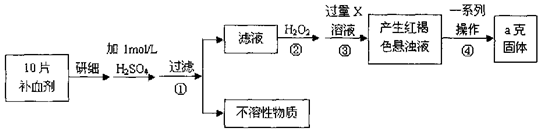
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 3O2(g)=2O3(g)△H=+242.4kJ•mol-1 | |
| B. | 氧气比臭氧稳定,大气中臭氧层易被破坏 | |
| C. | 断裂l mol O2(g)中的共价键吸收的能量比形成1 molCO2(g)中的共价键放出的能量少 | |
| D. | 相同物质的量的氧气比臭氧所含的能量高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com