
A��B��C��D��E��F��G��L��I��������Ԫ�طֲ���������ͬ�Ķ����ڣ����ǵ�ԭ������������������B��C��DΪͬһ���ڣ�A��E��B��G��D��L�ֱ�Ϊͬһ���壬C��D��F����Ԫ�ص�ԭ������֮��Ϊ28��F����������D��5��D��������������F��2����C��D������������֮��Ϊ11����ش��������⣺
��1�����Ϸǽ���Ԫ�������γɵ������̬�⻯���ȶ����������ǣ��ѧʽ�� ��E��F��L��I���γɵļ����ӵİ뾶�ɴ�С��˳��Ϊ�������ӷ��ű�ʾ�� ��
��2����L��I��Ԫ�ؿɰ�ԭ�Ӹ�����1:1��ɻ�����X��������X�и�ԭ�Ӿ�����8���ӵ��ȶ��ṹ����X�ĵ���ʽΪ �����廯����E2D2Ͷ�뵽������E2L��ˮ��Һ�У�ֻ�۲쵽�г��������ģ�д���÷�Ӧ�����ӷ���ʽ ��
��3����10 L���ܱ������У�ͨ��2 mol LD2�����1 mol D2���壬һ���¶��·�Ӧ������LD3���壬����Ӧ�ﵽƽ��ʱ��D2��Ũ��Ϊ0.01 mol·L-1��ͬʱ�ų�Լ177 KJ����������ƽ��ʱLD2��ת����Ϊ ���÷�Ӧ���Ȼ�ѧ����ʽΪ�� ��
��֪ʶ�㡿Ԫ�����ڱ���Ԫ�������� ��ѧƽ�� �Ȼ�ѧ����ʽ E2 F1 G2
���𰸽�������1��SiH4 �� S2->Cl->Na+>Al3+ ��
��2�� 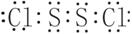 �� Na2O2 + Na2S + 2H2O = S + 4NaOH ��
�� Na2O2 + Na2S + 2H2O = S + 4NaOH ��
��3�� 90% �� 2SO2(g)+ O2(g)= 2SO3(g) ��H = - 196.7 KJ/mol ��
������A��B��C��D��E��F��G��H����Ԫ�طֲ���������ͬ�Ķ����ڣ����ǵ�ԭ����������������AΪ��Ԫ�أ�A��Eͬһ���壬����֪EΪNa��B��C��DΪͬһ���ڣ�Ӧ���ڵڶ����ڣ�E��F��G��H�����ڵ������ڣ���F������������Ϊx����������Ϊ10+x����Dԭ������������Ϊ2x��������Ϊ2+2x������F����������D��5�����У�10+x-��2-2x��=5�����x=3����FΪAl��DΪO��C��ԭ������=28-8-13=7��CΪN��D��LΪͬ���壬��LΪS��I��Cl��B��Gͬ���壬���ԭ��������֪�����ڢ�A�壬��BΪC��GΪSi��
��1�����ַǽ�����Si�ķǽ��������������γɵ������̬�⻯��SiH4�ȶ���������
���Ӳ�ṹ��ͬ�˵����Խ�����Ӱ뾶ԽС�����Ӳ�Խ�����Ӱ뾶Խ�����Ӱ뾶 S2->Cl->Na+>Al3+ ��
��2��L��I��Ԫ�ؿɰ�ԭ�Ӹ�����1:1��ɻ�����X��������X�и�ԭ�Ӿ�����8���ӵ��ȶ��ṹ����X��S2Cl2��Na2O2��Na2S��ˮ��Һ��Ӧ���ɵ���S��ͬʱ����NaOH���÷�Ӧ�����ӷ���ʽΪ��Na2O2+2H2O+S2-=S+4Na++4OH-��
��3�� 2SO2��g��+O2��g��⇌2SO3��g��
��ʼ��mol/L����0.2 0.1 0
�仯��mol/L����0.18 0.09 0.18
ƽ�⣨mol/L����0.02 0.01 0.18
��ƽ��ʱSO2��ת����Ϊ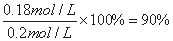
�μӷ�Ӧ������������ʵ���=0.18mol/L��10L=1.8mol��ͬʱ�ų�Լ177kJ����������2mol��������Ӧ�ų�������Ϊ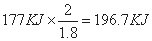
�÷�Ӧ���Ȼ�ѧ����ʽΪ��2SO2��g��+O2��g��⇌2SO3��g����H=-196.7kJ/mol��
��˼·�㲦�����⿼����Ԫ�����ڱ���Ԫ�������ɣ���ѧƽ�⼰�Ȼ�ѧ����ʽ�������õ�����Ԫ�طֱ���ʲôԪ���ǹؼ���


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪X��M������ѧ�̲ij���Ԫ��,���ж��������ӷ�Ӧͨʽ���ƶ���,������ȷ����( )
(��) XO3n-+Xn- + H+ ��X����+ H2O(δ��ƽ); (��)Mm++mOH-��M(OH)m��
����n=1,��XO3n-��XԪ��Ϊ+5��,Xλ�����ڱ��ڢ�A��
����n=2,��X����������ˮ��������������⻯�ﷴӦ
����m=1,��M��NO3��m��Һ�Ͱ�ˮ����ʱ��������ܲ�ͬ
����m=2,���ڿ��������ɡ�����MSO4��Һһ���ܵõ�MSO4
����m=3,��MCl3����������������Һ��Ӧһ������M��OH��m
A���٢� B�� �ڢ� C�� �٢� D�� �ܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
.����һ�������������MgSO4�Ļ����Һ����μ���Ba(OH)2��Һ����������������m�����Ba(OH)2�����ʵ���n֮��Ĺ�ϵ��ͼ��ʾ������˵����ȷ����

A. 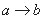 ʱ�ij����ɷ�ΪBaSO4��Mg(OH)2
ʱ�ij����ɷ�ΪBaSO4��Mg(OH)2
B. 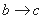 ʱ���������ӷ�ӦΪH++OH-=H2O
ʱ���������ӷ�ӦΪH++OH-=H2O
C. c��ʱ����Һ��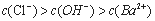
D. ԭ�����Һ�У�n(HCl)=2mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������A��B��C��D���ֶ�����Ԫ�أ�����֮��Ĺ�ϵ���£�
��ԭ�Ӱ뾶��A < C < B < D ��ԭ�ӵ�������������A + C = B + D = 8
��ԭ�ӵĺ�����Ӳ�����B = C = 2A ����BԪ�ص���Ҫ���ϼۣ�������� + ����� = 2
��ش�
��1����A��B����Ԫ����ɵij������壬�����ʽΪ ��ֻ��A��B����Ԫ����ɵ��������Ӿ���Ļ��������Ϊ ���û�ѧʽ��ʾ����
��2����DԪ���γɵ����������ǿ����Һ��Ӧ�����ӷ���ʽΪ ��
��3����B��CԪ����ɵĻ�����BC3���û��������ǿ�����ԣ���ˮ��Ӧ�����������һ����ɫ���壬�����峣���������������ɫ��д���û�������ˮ��Ӧ�Ļ�ѧ����ʽ ��
��4����A��B��C����Ԫ����ɵ��Σ���������ˮ��Һ�����ԣ���0.1 mol·L-1 ������Һ��Ũ����������Ϊ ��д���ӷ��ţ���д��������������������ӵ�ʵ�鷽�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��������ʵ���г�����Ӧ������ȷ����
| ʵ����ʵ | ���� | |
| A | Cl2��ˮ��Һ���Ե��� | Cl2�ǵ���� |
| B | SO2ͨ�����ᱵ��Һ���ְ�ɫ���� | BaSO3������ǿ�� |
| C | NaHCO3��Һ��NaAlO2��Һ��ϲ�����ɫ���� | ���H+��������CO32-<AlO2- |
| D | �����°�����ȼ�����������ڷŵ�ʱ������ ����Ӧ | �ǽ����ԣ�P>N |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������Ԫ��X��Y��Z��ԭ���������ε�������ԭ�ӵ�����������֮��Ϊ13��X��Y��Zλ���������ڣ�Zԭ��������������Xԭ���ڲ��������3��������Yԭ��������������3��������˵����ȷ����
A��X���⻯������ˮ��������
B��Z���⻯���ˮ��Һ�ڿ����д�Ų��ױ���
C��Y��X������Y3X2�ͻ�����
D��Z�ĵ�����������ȼ�տ���������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ÿ���и����������ʣ����Ƕ����÷�Һ©���������(����)
A������������ˮ���ƾ���ˮ�����Ӻ�ˮ
B�����������ˮ���屽��ˮ����������ˮ
C�����ͺ�ˮ����ȩ��ˮ��������Ҵ�
D�������ˮ���ױ���ˮ������ͱ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ұ��ҵ�ϣ���������ͨ����ѧ��ԭ���ƵõĽ������� (����)��
A��Na��Ba��Mg��Al B��Na��K��Zn��Fe
C��Zn��Fe��Cu��Ag D��Mg��Al��Zn��Fe
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ͭƬ��пƬ��200 mL ϡH2SO4��ɵ�ԭ����У���пƬֻ�����绯ѧ��Ӧ����ͭƬ�Ϲ��ų�3.36 L(��״��)����ʱ��H2SO4ǡ����ȫ���ġ���
(1)��Ӧ�����ĵ�п��������________
(2)ԭϡH2SO4�����ʵ���Ũ����________
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com