
| A、1molFeCl3完全水解生成1molFe(OH)3胶粒 |
| B、常温常压下,1NA个一氯甲烷分子的体积大于22.4L |
| C、T℃时,1 L pH=6纯水中,含10-8NA个OH- |
| D、3.4g NH3中含N-H键数目为0.2NA |
| m |
| M |
| m |
| M |
| 3.4g |
| 17g/mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
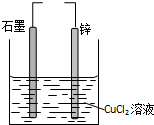
| A、若两电极直接连接,e-由外电路流向锌极 |
| B、若锌接电源负极,石墨接电源正极,锌上有气泡 |
| C、若两电极直接连接,则负极反应:Zn-2e-=Zn2+ |
| D、若锌接电源负极,石墨接电源正极,则Cu2+向石墨极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、乙醇在反应中发生了氧化反应 |
| B、为增强检测效果,加入盐酸酸化重铬酸钾溶液 |
| C、每1 mol乙醇参与反应转移电子物质的量为4mol |
| D、乙醇汽油是一种较清洁能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将1molNH4NO3溶于一定浓度的稀氨水中,溶液呈中性,若不考虑挥发,溶液中一定含有NA个NH4+ |
| B、1mol/LCH3COOH与1mol/L CH3COONa溶液等体积混合,溶液中CH3COOH和CH3COO-的总数为2NA |
| C、常温常压下,3.6g H2O中含有电子数为2NA |
| D、含有2NA个氧原子的氧气与臭氧的混合气体的质量为32g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.15 mol NO2与水完全反应时转移的电子数为0.1 NA |
| B、标准状况下,224 mL水含有的电子数为0.1 NA |
| C、常温常压下,0.56 L甲烷中含有的共价键数为0.1NA |
| D、25℃,pH=l的稀硫酸中含有的H+数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.36L |
| B、6.72 L |
| C、8.96 L |
| D、4.48 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 试剂/mL | 甲 | 乙 | 丙 | 丁 |
| 4mol/L H2SO4 | 20 | V1 | V2 | V3 |
| 饱和CuSO4溶液 | 0 | 2.5 | V4 | 10 |
| H2O | V5 | V6 | 8 | 0 |
| A、实验甲产生气泡的速率最快 |
| B、V1<V2<V3<20 |
| C、V4=V5=10 |
| D、V6=7.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:


| 密度 (g/cm3) | 熔点 (℃) | 沸点 (℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com