
【题目】常温下,用0.10 mol·L-1 NaOH溶液分别滴定20.00 mL浓度均为0.10 mol·L-1 CH3COOH溶液和HCN溶液,所得滴定曲线如下图。下列说法正确的是

A. 点①和点②所示溶液中:c(CH3COO-)<c(CN-)
B. 点③和点④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C. 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
D. 点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
【答案】C
【解析】
常温下用0.10mol/LNaOH溶液分别滴定20.00mL浓度均为0.10mol/LCH3COOH溶液和HCN,对于同浓度同体积的CH3COOH和HCN来说,根据起始pH大小可判断酸性CH3COOH>HCN,结合图象和溶液中的守恒思想,据此判断分析。
常温下用0.10mol/LNaOH溶液分别滴定20.00mL浓度均为0.10mol/LCH3COOH溶液和HCN,对于同浓度同体积的CH3COOH和HCN来说,根据起始pH大小可判断酸性CH3COOH>HCN。
A.点①的溶液中存在电荷守恒为c(OH-)+c(CN-)=c(Na+)+c(H+),而且c(OH-)>c(H+),点②所示溶液中的电荷守恒为c(OH-)+c(CH3COO-)=c(Na+)+c(H+),而且c(OH-)<c(H+),二者中钠离子浓度相同,所以c(CH3COO-)>c(CN-),选项A错误;
B.点③中pH=7,则c(OH-)=c(H+),则点③中c(Na+)=c(CH3COO-)>c(H+)=c(OH-),选项B错误;
C.点①的溶液中存在物料守恒为c(HCN)+c(CN-)=c(Na+),点②所示溶液中的物料守恒为c(CH3COOH)+c(CH3COO-)=c(Na+),二者中钠离子浓度相同,则c(HCN)+c(CN-)=c(CH3COOH)+c(CH3COO-),即c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH),选项C正确;
D.点②和点③所示溶液中存在电荷守恒c(OH-)+c(CH3COO-)=c(Na+)+c(H+),在③中Na元素的物质的量与醋酸的总物质的量相同,由于醋酸根离子要水解,所以c(Na+)>c(CH3COOH),所以c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),选项D错误。
答案选C。


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案科目:高中化学 来源: 题型:
【题目】 ![]() 和
和![]() 是钍的两种同位素,
是钍的两种同位素,![]() 可以转化成
可以转化成![]() 。下列有关 Th 的说法正确的是( )
。下列有关 Th 的说法正确的是( )
①Th 元素的质量数是 232 ②![]() 和
和![]() 的化学性质相同 ③
的化学性质相同 ③![]() 转换成
转换成![]() 是化学变化 ④Th 元素的相对原子质量是 231 ⑤
是化学变化 ④Th 元素的相对原子质量是 231 ⑤![]() 和
和 ![]() 具有相同的最外层电子数
具有相同的最外层电子数
A.①②B.③④C.②⑤D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯活性氧化锌可用于光催化、光电极、彩色显影等领域。以工业级氧化锌(含Fe2+、Mn2+、Cu2+、Ni2+、Cd2+等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下:

已知Ksp[Fe(OH)3]=4.0×10-38。
回答下列问题:
(1)浸出时,为了提高浸出效率可采用的措施有(写两种):___________;___________。
(2)氧化时,加入KMnO4溶液是为了除去浸出液中的Fe2+和Mn2+(溶液中Mn全部转化为MnO2),请配平下列除去Fe2+的离子方程式:MnO![]() +Fe2++ ===MnO2↓+Fe(OH)3↓+H+ ____________
+Fe2++ ===MnO2↓+Fe(OH)3↓+H+ ____________
(3)加入锌粉的目的是_______________________________________________________。
(4)已知H2SO4浸出液中,c(Fe2+)=5.04 mg·L-1、c(Mn2+)=1.65 mg·L-1,加入KMnO4溶液反应一段时间后,溶液中c(Fe3+)=0.56 mg·L-1,若溶液pH=3,则此时Fe3+__________(填“能”或“不能”)生成沉淀。
(5) 已知:常温下,①Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11;②H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH的变化关系如图所示。

①比较H2R ,HR-,H2CO3三者的酸性强弱_________________________________
②NaHR溶液中存在![]() = _______________________
= _______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白藜芦醇属二苯乙烯类多酚化合物,具有抗氧化、抗癌和预防心血管疾病的作用。某课题组提出了如下合成路线:

已知:
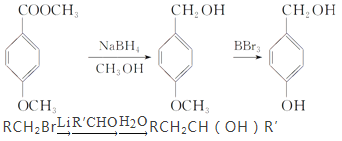
根据以上信息回答下列问题:
(1)白藜芦醇的分子式是________。
(2)C→D的反应类型是_________;E→F的反应类型是________。
(3)化合物A不与FeCL3溶液发生显色反应,能与NaHCO3反应放出CO2,推测其核磁共振氢谱(1H-NMR)中显示有_______种不同化学环境的氢原子,其个数比为_______。
(4)写出A![]() B反应的化学方程式_______
B反应的化学方程式_______
(5)写出化合物D、E的结构简式:D_______,E_______。
(6)化合物![]() 有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式:______。
有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式:______。
①能发生银镜反应;②含苯环县苯环上只有两种不同化学环境的氢原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的SO2(g)和O2(g)分别通入体积为2L的恒容密闭容器中,在不同温度下进行反应:2SO2(g)+ O2(g)![]() 2SO3 △H<0。得到如表中的两组数据,下列说法不正确的是
2SO3 △H<0。得到如表中的两组数据,下列说法不正确的是
实验编号 | 温度/℃ | 平衡常数/mol-1·L | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
SO2 | O2 | SO2 | O2 | ||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
A. T1、T2的关系:T1 > T2
B. x= 1.6,y=0.2 ,t<6
C. K1、K2的关系:K2>K1
D. 实验1在前6min的反应速率υ(SO2)=0.2 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求答题:
(1)金属焊接时可用NH4Cl溶液作除锈剂的原因(用离子方程式回答)_____________________________。
(2)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=_____________mol·L-1(填精确值)。
(3)常温下,将pH=a的NaOH溶液与pH=b的醋酸溶液等体积混合后,两者恰好完全反应,则该温度下醋酸的电离平衡常数约为_______________________(用含代数a、b等表示)。
(4)常温,PH=5 的H2SO4溶液加水稀释至原溶液体积的1000倍,求稀释后溶液中c(H+):c(SO42-)=________
(5)已知:H2CO3的电离平衡常数 K1=4.4×10-7 ; K2=4.7×10-11,HClO的电离平衡常数K=3.0×10-8,则将少量CO2气体通入NaClO溶液中的离子方程式____________________
(6)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )
A. 2H2(g)+O2(g) == 2H2O(1) △H= ―285.8kJ/mol![]()
B. 2H2(g)+ O2(g) == 2H2O(1) △H= +571.6 kJ/mol
C. 2H2(g)+O2(g) == 2H2O(g) △H= ―571.6 kJ/mol
D. H2(g)+1/2O2(g) == H2O(1) △H= ―285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将氯化铝溶液蒸干灼烧得到的固体物质是(填化学式)____________向纯碱溶液中滴入几滴酚酞会变红,原因是(用离子方程式表示)_______________ 。
(2)牙齿表面由一层坚硬的、组成为Ca5(PO4)3OH的物质保护着。它在唾液中存在下列平衡:Ca5(PO4)3OH(s)![]() 5Ca2++3PO43-+OH-。进食后细菌和酶作用于食物产生有机酸,这时牙齿就会受到腐蚀,其原因是_____________________________________________。
5Ca2++3PO43-+OH-。进食后细菌和酶作用于食物产生有机酸,这时牙齿就会受到腐蚀,其原因是_____________________________________________。
(3)1g碳与适量水蒸气反应生成CO和H2,需吸收10.94KJ热量,此反应的热化学方程式为_________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,其元素特征信息如下表
元素 | 元素特征信息 |
A | 其单质是密度最小的物质。 |
B | 阴离子带两个单位负电荷,单质是空气的主要成分之一。 |
C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物。 |
D | 其氢氧化物和氧化物都有两性,与C同周期 |
E | 与C同周期,原子半径在该周期最小 |
回答下列问题:
(1)写出下列元素的名称:C___________,E______________
(2)写出A、B、C形成的化合物的电子式____________________
(3)B、C、D的简单离子半径由大到小的顺序是(用化学式表示)____________________
(4)写出E单质与A、B、C形成的化合物反应的化学方程式:__________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com