
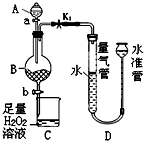
 工业生产中会产生大量的废铁屑,可将其“变废为宝”制成化工原料氯化铁.实验室中利用如图所示装置探究由废铁屑制备FeCl3•6H2O晶体的原理并测定铁屑中铁单质的质量分数(杂质不溶于水且不与酸反应).
工业生产中会产生大量的废铁屑,可将其“变废为宝”制成化工原料氯化铁.实验室中利用如图所示装置探究由废铁屑制备FeCl3•6H2O晶体的原理并测定铁屑中铁单质的质量分数(杂质不溶于水且不与酸反应).分析 (1)根据装置图分析;
(2)检验装置的气密性,应该先形成密闭体系,在水准管中加水,使水准管液面高于量气管液面,根据液面变化判断;
(3)盐酸与Fe反应生成氯化亚铁,加双氧水把亚铁离子氧化为铁离子;
(4)水准管的液面高,应该降低水准管的高度;
(5)根据从溶液中提取可溶性溶质的操作分析;
(6)Fe+2HCl=FeCl2+H2↑,根据氢气的体积求出物质的量,再根据方程式求出Fe的物质的量、质量,即可求出Fe的质量分数.
解答 解:(1)由装置图可知装置A为分液漏斗,故答案为:分液漏斗;
(2)检验装置的气密性,应该先形成密闭体系,即关闭活塞a和活塞b,打开弹簧夹K1;然后在水准管中加水,使水准管液面高于量气管液面,一段时间后,水准管内液面高于量气管内液面,且液面差保持稳定,说明气密性良好;
故答案为:关闭活塞a和活塞b;一段时间后,水准管内液面高于量气管内液面,且液面差保持稳定;
(3)盐酸与Fe反应生成氯化亚铁,实验目的是制备FeCl3•6H2O晶体,则要加双氧水把亚铁离子氧化为铁离子,其反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O,
故答案为:H2O2+2Fe2++2H+=2Fe3++2H2O;
(4)由装置图可知,水准管的液面高,应该降低水准管的高度,即应将水准管下移,故答案为:下移;
(5)从溶液中提取可溶性溶质的操作:蒸发浓缩、冷却结晶、过滤,则用到的仪器为蒸发皿、烧杯、酒精灯、玻璃棒、漏斗,则不需要分液漏斗和坩埚,
故答案为:de;
(6)实验结束后,若量气管内共收集到VmL气体,则n(H2)=$\frac{V}{Vm}$=$\frac{V}{22400}$mol,由Fe+2HCl=FeCl2+H2↑可知,n(Fe)=n(H2)=$\frac{V}{22400}$mol,
所以m(Fe)=nM=$\frac{V}{22400}$mol×56g/mol=2.5V×10-3g,
则此废铁屑中铁单质的质量分数为:$\frac{2.5V×1{0}^{-3}g}{mg}$×100%=$\frac{2.5V×1{0}^{-3}}{m}$×100%,
故答案为:$\frac{2.5V×1{0}^{-3}}{m}$×100%.
点评 本题考查了物质的制备、物质含量的测定,侧重于考查基本实验操作、氧化还原反应、物质含量的有关计算等,难度中等,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:选择题
| A. | ClO-、Na+、SO42-、NO3- | B. | Na+、Mg2+、S2-、SO${\;}_{{3}^{\;}}$2- | ||
| C. | Na+、K+、Cl-、OH- | D. | K+、Ca2+、H+、NO${\;}_{3}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ② | C. | ③ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:SiO2<CO2 | B. | 沸点:H2O<H2S | ||
| C. | 晶格能:CaCl<NaCl | D. | 热稳定性:HF<HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向反应后的溶液加入乙醇,溶液没有发生变化 | |
| B. | 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+ | |
| C. | 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 | |
| D. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 | 0.1MPa | 0.5MPa | 1MPa | 1.5MPa |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 氯气的氧化性 | 将湿润的淀粉KI试纸放于充满 Cl2的集气瓶口,试纸变蓝 |
| B | 配制 480mL 0.2mol/L NaOH溶液 | 准确称量NaOH固体4.0g溶于水,配制成 500mL溶液 |
| C | 比较 H2CO3 和 H2SO4的酸性强弱 | 室温下,用PH试纸测定浓度为O.lmol•L-1Na2CO3溶液和 0.lmol•L-1NazSO4溶液的 pH |
| D | 证明氧化性: H2O2>Fe3+ | 用硫酸酸化的H2O2滴入Fe(NO3)2洛液中,浓液变黄色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B3N3H6分子各原子均在同一平面上 | |
| B. | B3N3H6是由极性键组成的均匀而对称的非极性分子 | |
| C. | B3N3H6能发生加成反应和取代反应 | |
| D. | B3N3H6的二氯取代物有三种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com