
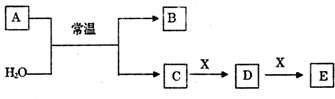
| A. | CaCO3不溶于水,所以CaCO3不是电解质 | |
| B. | 分解反应不一定是氧化还原反应 | |
| C. | 盐、碱一定含有金属元素 | |
| D. | 在水溶液中电离产生H+的化合物一定是酸 |
分析 A.碳酸钙在熔融状态下能够导电,属于强电解质;
B.分解反应中不一定存在元素化合价变化,所以不一定属于氧化还原反应;
C.铵盐为盐、一水合氨为碱,它们都不含金属元素;
D.在水溶液中电离的阳离子全部为H+的化合物一定是酸,但是电离氢离子的物质的量不一定为酸,如硫酸氢钠、水等.
解答 解:A.电解质与溶解度大小没有关系,碳酸钙溶于水的部分完全电离,且在熔融状态下能够导电,则碳酸钙为强电解质,故A错误;
B.存在元素化合价变化的反应为氧化还原反应,分解反应中若没有元素化合价变化,则不属于氧化还原反应,故B正确;
C.盐、碱不一定含有金属元素,如氯化铵、硫酸铵等铵盐属于盐,一水合氨属于碱,故C错误;
D.在水溶液中电离产生H+的化合物不一定是酸,如水能够电离出氢离子,硫酸氢钠、硫酸氢铵等都能够电离出氢离子,它们不属于酸,只有电离出的阳离子全部为氢离子的混合物才是酸,故D错误;
故选
点评 本题考查较为综合,涉及电解质的判断、氧化还原反应、酸、碱、盐的判断等知识,题目难度中等,明确电解质与非电解质的全部为解答关键,注意掌握酸碱盐的概念及判断方法.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4NO3=NH4++NO3- | B. | CH3COOH=H++CH3COO- | ||
| C. | NH3•H2O?NH4++OH- | D. | NaHCO3=Na++HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
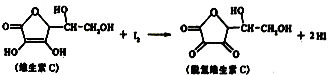
| A. | 脱氢维生素C的分子式为C6H7O6 | B. | 上述反应为取代反应 | ||
| C. | 滴定时反应剧烈振荡锥形瓶 | D. | 滴定时可用淀粉溶液作指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
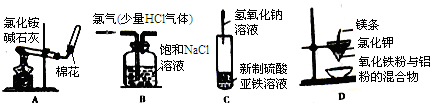
| A. | 实验室制取并收集氨气 | B. | 除去Cl2中的HCl气体杂质 | ||
| C. | 实验室制取氢氧化亚铁 | D. | 铝热反应实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液加入过量的氨水:Al3++4NH3•H2O═[Al(OH)4]-+4 NH4+ | |
| B. | 氯化亚铁溶液通入氯气:2Fe2++Cl2═2Fe3++2Cl- | |
| C. | 硫酸铵溶液与氢氧化钡溶液混合:NH4++OH-═NH3↑+H2O | |
| D. | 铁与稀盐酸;2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫单质是一种淡黄色易溶于水的固体 | |
| B. | SO2的漂白原理与活性炭相同 | |
| C. | 可用澄清石灰水鉴别SO2和CO2 | |
| D. | 可用铁质或铝质容器储存浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com