
工业上合成氨是在一定条件下进行如下反应:
N2(g)+3H2(g)![]() 2NH3(g),其部分工艺流程如下:
2NH3(g),其部分工艺流程如下:
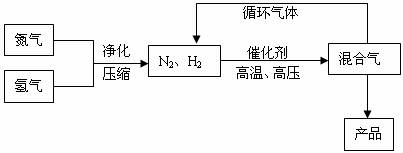
回答下列问题:
(1)已知:N2(g)+O2(g) =2NO(g); △H=180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ;△H=-905kJ/mol
2H2(g)+O2(g)=2H2O(g) ; △H=-483.6kJ/mol
则工业合成氨的热化学方程式为_______________。
(2)如果工业上,在一定温度下,将1.5molN2 气体和6molH2 气体通入到体积为1升的密闭容器中。改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是______。
①增大压强 ②增大反应物的浓度 ③使用催化剂 ④降低温度
(3)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过降低混合气体的温度而使氨气分离出来。这种分离物质的方法其原理类似于下列哪种方法?______ (填编号)。①过滤 ②蒸馏 ③渗析 ④萃取 理由是________________________。
(4)可以用氯气来检验输送氨气的管道是否漏气,如果漏气则会有白烟(成份为氯化铵)生成。该反应的化学方程式为:_________________________________。
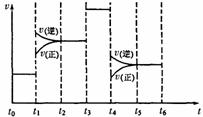
(5)如果化学反应3A2(g)+C2(g)![]() 2CA3(g)。当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),下图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是____________。温度为T℃时,将4amolA2和2a molC2放入1L密闭容器中,充分反应后测得C2的转化率为50%,则反应的平衡常数____________。
2CA3(g)。当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),下图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是____________。温度为T℃时,将4amolA2和2a molC2放入1L密闭容器中,充分反应后测得C2的转化率为50%,则反应的平衡常数____________。
科目:高中化学 来源: 题型:

| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210.01 | -252.77 | -77.74 |
| 沸点(℃) | -195.79 | -259.23 | -33.42 |
| [NH3]2 |
| [N2][H2]3 |
| [NH3]2 |
| [N2][H2]3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | 2- 3 |
| O | - 3 |
| H | + 4 |

查看答案和解析>>
科目:高中化学 来源:2013届安徽省高三上学期开学水平检测考试化学试卷(解析版) 题型:填空题
(14分)工业上合成氨是在一定条件下进行如下反应:N2(g) + 3H2(g) ≒ 2NH3(g),其部分工艺流程如下:
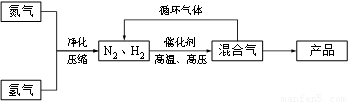
回答下列问题:
(1) 已知: N2(g)
+ O2(g)  2NO(g) ΔH
2NO(g) ΔH +180.5kJ/mol
+180.5kJ/mol
4NH3(g)
+ 5O2(g)  4NO(g) + 6H2O(g) ΔH
4NO(g) + 6H2O(g) ΔH −905kJ/mol
−905kJ/mol
2H2(g)
+ O2(g)  2H2O(g) ΔH
2H2O(g) ΔH −483.6kJ/mol
−483.6kJ/mol
则N2(g)
+ 3H2(g) ≒ 2NH3(g) ΔH  ________________。
________________。
(2) 如果工业上,在一定温度下,将1.5 mol N2气体和6 mol H2气体通入到体积为1升的密闭容器中。当反应达到平衡时,容器内气体的压强为起始时的80%,则其平衡常数为_______。改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是__________。
①增大压强 ②增大反应物的浓度 ③使用催化剂 ④降低温度
(3) 合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过降低混合气体的温度而使氨气分离出来。这种分离物质的方法其原理类似于下列方法中的________(填编号),其理由是__________。
①过滤 ②蒸馏 ③渗析 ④萃取
(4) 可以用氯气来检验输送氨气的管道是否漏气,如果漏气则会有白烟(成分为氯化铵)生成,该反应的化学方程式为__________。
(5) 假如该厂生产氨水的物质的量浓度为20 mol/L,实验室若需用80 mL浓度为5 mol/L的氨水时,需取20 mol/L的氨水__________mL(用100 mL的容量瓶)。假如该氨水的 ,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________
,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________ (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年河南省信阳市高三第二次调研考试化学试卷 题型:填空题
(10分)工业上合成氨是在一定条件下进行如下反应:
N2(g)+3H2(g) 2NH3(g)回答下列问题:
2NH3(g)回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g);△H=+180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g); △H=-905kJ/mol
2H2(g)+O2(g)=2H2O(g); △H=-483.6kJ/mol
则N2(g)+3H2(g) 2NH3(g)的△H=_______________。
2NH3(g)的△H=_______________。
(2)(NH4)2SO3和NH4HSO4是两种化工原料。
①对于(NH4)2SO3溶液,某同学写出了如下的正确关系式:
2[c( )+c(
)+c( )+c(H2SO3)]=c(
)+c(H2SO3)]=c( )+c(NH3·H2O)
)+c(NH3·H2O)
该同学的依据是:_________________________________________
⑦写出NH4HSO4溶液中离子浓度由大到小的顺序:______________________。
(3)甲烷——空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液。现用甲烷——空气燃料电池进行下图所示实验(其中a、b均为碳棒):

①Zn片上发生的电极反应式:_____________________。
②a电极的电极反应式_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com