
【题目】在研究原子核外电子排布与元素周期表的关系时, 人们发现价电子排布相似的元素集中在一起。据此,人们将元素周期表分为五个区,并以最后填入电子的轨道能级符号作为该区的符号,如下图所示。

(1)在![]() 区中,族序数最大、原子序数最小的元素,原子的价电子的电子云形状为__________。
区中,族序数最大、原子序数最小的元素,原子的价电子的电子云形状为__________。
(2)在![]() 区中,族序数最大、原子序数最小的元素,常见离子的电子排布式为__________,其中较稳定的是__________。
区中,族序数最大、原子序数最小的元素,常见离子的电子排布式为__________,其中较稳定的是__________。
(3)在第4周期的![]() 区中,族序数最大、原子序数最大的元素,原子的价电子排布式为__________。
区中,族序数最大、原子序数最大的元素,原子的价电子排布式为__________。
(4)在![]() 区中,第2周期VA族元素原子价电子排布图为__________。
区中,第2周期VA族元素原子价电子排布图为__________。
(5)当今常用于核能开发的元素是铀和钚,它们在__________区中。
【答案】球形 Fe2+ 1s22s22p63s23p63d6,Fe3+ 1s22s22p63s23p63d5 Fe3+ 3d104s2 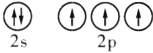 f
f
【解析】
(1)在s区中,族序数最大的元素为第ⅡA族,其原子的价电子排布式应为ns2;
(2)在d区中,族序数最大、原子序数最小的元素为Fe,常见离子为亚铁离子、铁离子,根据洪特规则特例判断离子稳定性;
(3)在ds区中,原子序数最大的元素为第ⅡB族,原子的价电子排布式应为3d104s2;
(4)在p区第2周期、ⅤA族元素为N,原子价电子排布为2s22p3;
(5)常用于核能开发的元素是铀和钚,它们在f区中。
(1)在s区中,族序数最大的元素为第ⅡA族,其原子的价电子排布式应为ns2,所以其原子的价电子的电子云形状为球形,故答案为:球形;
(2)在d区中,族序数最大、原子序数最小的元素为VIII的Fe,常见离子为二价铁离子和三价铁离子,其离子的电子排布式分别为1s22s22p63s23p63d6和1s22s22p63s23p63d5 ,Fe3+的最外层为3d5,为半满稳定结构,而Fe2+的最外层为3d6,不是稳定结构,故Fe3+较稳定;
(3)在第4周期的ds区中,原子序数最大的元素为第ⅡB族的Zn元素,其原子的价电子排布式应为3d104s2;
(4)在p区第2周期、ⅤA族元素为N,原子价电子排布为2s22p3,原子价电子的轨道表示式为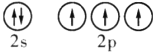 ;
;
(5)常用于核能开发的元素是铀和钚,它们在f区中。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】电离平衡常数是衡量弱电解质电离程度的物理量,已知如表数据(25℃):
化学式 | 电离平衡常数 |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
(1)25℃时,下列物质的量浓度相同的四种溶液的pH由大到小的顺序为_____(填字母,下同)。
a.NaCN溶液 b.Na2CO3溶液 c.CH3COONa溶液 d.NaHCO3溶液
(2)25℃时,向NaCN溶液中通入少量CO2,所发生的化学方程式为____________________。
(3)等物质的量的Na2CO3和NaHCO3混合溶液中各离子浓度由大到小的顺序为____________________。
(4)对于醋酸溶液和醋酸钠溶液的下列说法正确的是__________。
a.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小
b.升高温度可以促进醋酸电离,而升高温度会抑制醋酸钠水解
c.醋酸和醋酸钠的混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离
d.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离
(5)25℃,已知pH = 2的高碘酸溶液与pH = 12的NaOH溶液等体积混合,所得混合液显酸性;0.01 mol/L的碘酸或高锰酸溶液与pH = 12的NaOH溶液等体积混合,所得混合液显中性。则高碘酸是____________(填“强酸”或“弱酸”);高锰酸是___________(填“强酸”或“弱酸”)。将可溶性的高碘酸钡[Ba5(IO6)2]与稀硫酸混合,发生反应的离子方程式为:__________________________________________________。
(6)用生石灰吸收CO2可生成难溶电解质CaCO3,其溶度积常数Ksp=2.8×10-9。现有一物质的量浓度为2×10-4mol/L纯碱溶液,将其与等体积的CaCl2溶液混合,则生成沉淀所需CaCl2溶液的最小浓度为______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰的化合物在工业、医疗等领域有重要应用。某兴趣小组模拟制备KMnO4及探究锰(II)盐能否被氧化为高锰(VII)酸盐。
I.KMnO4的制备:
![]()
反应原理
步骤一:3MnO2+6KOH+KClO3![]() 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
步骤二:3K2MnO4+2CO2 =2KMnO4+MnO2+2K2CO3
实验操作
步骤一:将一定比例的MnO2、KOH和KClO3 固体混合加热,得到墨绿色的固体,冷却后加水溶解得到碱性K2MnO4溶液放入烧杯C中。
步骤二:连接装置,检查气密性后装药品。打开分液漏斗活塞,当C中溶液完全变为紫红色时,关闭活塞停止反应,分离、提纯获取KMnO4晶体。
装置图如下:

(1)检查装置A气密性:关闭分液漏斗活塞,在B中加入蒸馏水至液面超过长导管口,用热毛巾捂住圆底烧瓶,若__________,则说明装置气密性良好。
(2)B中试剂选择的理由________。
(3)反应结束后,未能及时分离KMnO4晶体,发现C中紫红色溶液变浅。该小组同学认为是碱性K2MnO4溶液中的Cl-将生成的MnO4- 还原,导致颜色变浅,指出含有Cl-的判断依据_____________。
II.该小组继续探究Mn2+能否氧化为MnO4-,进行了下列实验:
装置图 | 试剂X | 实验现象 |
| ① 0.5mL 0.1mol/LNaOH溶液 | 生成浅棕色沉淀,一段时间后变为棕黑色 |
②0.5mL 0.1mol/LNaOH 和15%H2O2 混合液 | 立即生成棕黑色沉淀 | |
③ 0.5mL 0.1mol/LHNO3溶液 | 无明显现象 | |
④ 0.5mL 0.1 mol/LHNO3溶液和少量PbO2 | 滴加HNO3无明显现象,加入PbO2立即变为紫红色,稍后紫红色消失,生成棕黑色沉淀 |
已知:i.MnO2为棕黑色固体,难溶于水;
iiKMnO4在酸性环境下缓慢分解产生MnO2。
(4)实验①中生成棕黑色沉淀可能的原因_____。
(5)实验②中迅速生成棕黑色沉淀的离子方程式_____。
(6)对比实验③和④,实验③的作用_____。
(7)甲同学猜测实验④中紫红色消失的原因:酸性条件下KMnO4不稳定,分解产生了MnO2,乙认为不成立,理由是________;乙认为是溶液中的Mn2+将MnO4- 还原,并设计了实验方案证明此推测成立,其方案为_________。
探究结果:酸性条件下下,某些强氧化剂可以将Mn2+氧化为MnO4-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组制备焦亚硫酸钠(Na2S2O5)并探究其性质。
资料:焦亚硫酸钠为白色晶体;可溶于水。
(1)制备Na2S2O5(夹持装置略)

① A为SO2发生装置,A中反应方程式是_____________________________________。
② B 中析出白色晶体,可采取的分离方法是___________________。
③ 将尾气处理装置C补充完整并标明所用试剂。___________________
(2) 探究Na2S2O5的性质
实验编号 | 实验操作及现象 |
实验Ⅰ | 取B中少量白色晶体于试管中,加入适量蒸馏水,得溶液a,测得溶液呈酸性。 |
实验Ⅱ | 取少量溶液a于试管中,滴加足量氢氧化钡溶液,有白色沉淀生成,过滤后,将沉淀放入试管中,滴加过量盐酸,充分振荡,产生气泡,白色沉淀溶解。 |
实验III | 取B中少量白色晶体于试管中,滴加1mL 2 mol / L酸性KMnO4溶液,剧烈反应,溶液紫红色很快褪去 。 |
实验IV | 取B中少量白色晶体于大试管中加热,将产生的气体通入品红溶液中,红色褪去;将褪色后的溶液加热,红色恢复。 |
① 由实验Ⅰ可知,Na2S2O5溶于水,溶液呈酸性的原因_______________________________________(用化学方程式表示) 。
② 实验Ⅱ中白色沉淀滴加过量盐酸,沉淀溶解,用平衡原理解释原因______________________。
③ 实验III中经测定溶液中产生Mn2+,该反应的离子方程式是_________________________。
④ 实验IV 中产生的气体为____________,实验中利用该气体的_________ 性质进行检验。
⑤ 从上述实验探究中,体现出Na2S2O5具有 _____________________性质。 ( 至少说出两点 )。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
下列判断不正确的是
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=![]() mol/L
mol/L
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1mol·L-1
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-) =c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应2A(s)+3B(g)![]() C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
①增加A的量,平衡向正反应方向移动②升高温度,平衡向逆反应方向移动,v(正)减小③压强增大一倍,平衡不移动,v(正)、v(逆)不变 ④增大B的浓度,v(正)>v(逆) ⑤加入催化剂,B的转化率提高
A. ①② B. ④ C. ③ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是( )
A.Cl2能与大多数金属化合,生成高价金属氯化物
B.新制氯水中加入AgNO3溶液,有白色沉淀生成
C.欲除去Cl2中的大量HCl气体,可将此混合气体通过盛有饱和食盐水的洗气瓶
D.漂白粉的有效成分是CaCl2和Ca(ClO)2,应密封保存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 在微生物作用的条件下,NH![]() 经过两步反应被氧化成NO
经过两步反应被氧化成NO![]() 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:

① 第一步反应是________(填“放热”或“吸热”)反应,判断依据是_______________________。
② 1 mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式是__________________________。
(2) 已知红磷比白磷稳定,则反应P4(白磷,s)+5O2(g)===2P2O5(s) ΔH1;4P(红磷,s)+5O2(g)===2P2O5(s) ΔH2;ΔH1和ΔH2的关系是ΔH1________ΔH2 (填“>”“<”或“=”)。
(3) 在298 K、101 kPa时,已知:
2H2O(g)===O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)===2HCl(g) ΔH2
2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2之间的关系正确的是________。
A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列各小题
(1)25°C时,0.1 mol·L-1NH4Cl溶液的pH____7(填“<”、“=”或“>”),其原因是_________(用离子方程式表示);
(2)下列物质能导电且属于电解质的是________(填序号)。
A.铁 B.盐酸 C.氯化钠晶体 D.熔融氢氧化钠
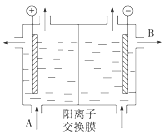
(3)可用阳离子交换膜法电解饱和食盐水制NaOH,其工作原理如下图所示。
①请写出A、B两处物质的名称:A_______________,B__________________。
②请写出电解食盐水的离子方程式__________________________________________。
(4)合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
温 度(℃) | 360 | 440 | 520 |
K值 | 0.036 | 0.010 | 0.0038 |
若25℃时1摩尔氮气完全转化为氨气放出92.4KJ的热量,写出工业合成氨的热化学方程式____________。
(5)合成氨的原料气H2还可通过反应CO(g) + H2O(g)![]() CO2 (g) + H2(g) 获取。
CO2 (g) + H2(g) 获取。
①T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为_______,该温度下反应的平衡常数K值为_________。
②保持温度仍为T ℃,只改变水蒸气和CO的初始物质的量之比,充入该容器进行反应,下列描述能够说明体系处于平衡状态的是_____________(填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO) : n(H2O) : n(CO2) : n(H2) = 1: 16 : 6 : 6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com