
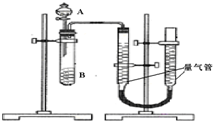
 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.该反应的离子方程式为2MnO4-+5H2C2O4+6H+═2Mn2++10CO2+8H2O.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.该反应的离子方程式为2MnO4-+5H2C2O4+6H+═2Mn2++10CO2+8H2O.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):| 序号 | A溶液 | B溶液 |
| ① | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
| ② | 2ml 0.1mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
| ③ | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液和少量MnSO4 |

| 实验编号 | 1 | 2 | 3 | 4 |
| 水/mL | 10 | 5 | 0 | X |
| 0.5mol/L H2C2O4/mL | 5 | 10 | 10 | 5 |
| 0.2mol/L KMnO4/mL | 5 | 5 | 10 | 10 |
| 时间/s | 40 | 20 | 10 | --- |
| △c |
| △t |
| △c |
| △t |
 ,
, ;
;| 5 |
| 2 |
| ||
| 20s |


科目:高中化学 来源: 题型:
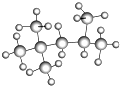 的名称(系统命名法)是
的名称(系统命名法)是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
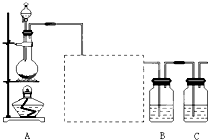
查看答案和解析>>
科目:高中化学 来源: 题型:
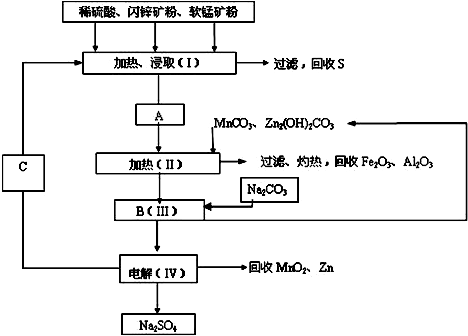
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba2+、Na+、Cl-、HSO3- |
| B、NH4+、K+、ClO-、S2- |
| C、Cu2+、Fe2+、NO3-、SO42- |
| D、Ag+、Na+、NH3?H2O、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、块状大理石和稀硫酸 |
| B、NH4Cl与稀NaOH溶液 |
| C、Na2O2与NaOH溶液 |
| D、铜片与稀盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com