
【题目】化学上以12C作为确定原子量的标准。若把12C的原子量定为24,并规定把24g12C所含碳原子数定为阿伏伽德罗常数,用NA表示,则下列推论中正确的是( )
A.12g碳单质完全燃烧需要体积约为11.2L(标准状况)的氧气
B.44gCO2和28gCO含有相同数目的分子
C.NA个氧分子和1mol氢分子的质量之比为8:1
D.氧气的摩尔质量为64g/mol,所以32g氧气所含分子数目为3.01×1025个
【答案】B
【解析】
A.12g碳单质物质的量n(C)=![]() =0.5mol,完全燃烧生成CO2气体需要O2物质的量1mol,标准状况下气体摩尔体积为44.8L/mol,需要氧气体积V(CO2)=0.5mol×44.8L/mol=22.4L,A错误;
=0.5mol,完全燃烧生成CO2气体需要O2物质的量1mol,标准状况下气体摩尔体积为44.8L/mol,需要氧气体积V(CO2)=0.5mol×44.8L/mol=22.4L,A错误;
B.若把12C的原子量定为24,44gCO2的物质的量n(CO2)=![]() =0.5mol,28gCO物质的量n(CO)=
=0.5mol,28gCO物质的量n(CO)=![]() =0.5mol,44gCO2和28gCO含有相同数目的分子,故B正确;
=0.5mol,44gCO2和28gCO含有相同数目的分子,故B正确;
C.NA个氧分子物质的量为1mol和1mol氢分子质量比,质量比=1mol×64g/mol:1mol×4g/mol=16:1,C错误;
D.氧气的摩尔质量为64g/mol,所以32g氧气物质的量n(O2)=![]() =0.5mol,所含分子数目为12.04×1023×0.5=6.02×1023,D错误;
=0.5mol,所含分子数目为12.04×1023×0.5=6.02×1023,D错误;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】298K时,在20.0mL0.10mol·L-1氯水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。己知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是

A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯的叠氮酸(HN3)是一种弱酸,常温下向25mL 0.1 mol/L NaOH溶液中加入0.2 mol/L HN3溶液,滴加过程中的pH值的变化曲线(溶液混合时的体积变化忽略不计)如下图。下列说法正确的是( )
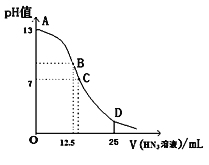
A. 该滴定过程中应用甲基橙作指示剂
B. 若B点pH=8,则c(HN3)=(10-6~10-8 )mol/L
C. 点D对应溶液中存在关系:c(HN3)>c(Na+)>c(N3-)
D. 沿曲线A→B→C的过程中,由水电离产生的c(OH-)逐渐减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列三组物质中,均有一种物质的类别与其他三种不同。
①MgO、Na2O、CO2、CuO②HCl、H2O、H2SO4、HNO3③NaOH、Na2CO3、KOH、Ba(OH)2
三种物质依次是(填化学式)_________、_______、________。
(2)某气体由双原子分子构成,它的摩尔质量为 Mg/mol。现有该气体 mg,按要求填空(设NA代表阿伏加德罗常数的数值,列表达式)
①该气体的物质的量为______mol;
②该气体在标准状况下的体积为______L;
③该气体在标准状况下的密度为______ g/L;
④该气体所含原子总数为______;
⑤该气体一个分子的质量为______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰元素在多个领域中均有重要应用,回答下列问题。
(1)Mn在元素周期表中位于_____区;MnSO4中阳离子的价电子排布式为__________;
(2)Mn3+在水溶液中容易歧化为MnO2和Mn2+下列说法合理的是_______
A.Mn3+的价电子构型为3d4,不属于较稳定的电子构型
B.根据Mn2+的电子构型可知,Mn4+中不含成对电子
C.Mn2+易被氧化,可能是因为Mn2+产内有大量自旋方向相同的电子
D.Mn2+与Fe3+具有相同的价电子构型,所以它们的化学性质相似
(3)在K2MnF6中,MnF62-的空间构型是正八面体,则中心原子的价层电子对数为_____。该化合物中含有的共价键在形成过程中原子轨道的重叠方式为__________
(4)二价锰的化合物的性质如下表所示:
物质 | MCl2 | MnS | MnSO4 |
熔点 | 650℃ | 1610℃ | 700℃ |
上表三种物质中晶格能最大的是________;上表涉及的三种阴离子中,半径最大的是______。
(5)某锰氧化物的晶胞结构如下图所示:

该锰的氧化物的化学式为______________,该晶体中Mn的配位数为____________,该晶体中Mn之间的最近距离为____________pm(用a、b来表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学平衡原理在工农业生产中发挥着重要的指导作用。
(1)反应C(s)+CO2(g) ![]() 2CO(g)平衡常数K的表达式为________________;
2CO(g)平衡常数K的表达式为________________;
已知C(s) + H2O(g)![]() CO(g)+H2(g)的平衡常数为K1;H2(g)+CO2(g)
CO(g)+H2(g)的平衡常数为K1;H2(g)+CO2(g) ![]() CO(g)+H2O(g)的平衡常数为K2 ,则K与K1、K2二者的关系为________________________。
CO(g)+H2O(g)的平衡常数为K2 ,则K与K1、K2二者的关系为________________________。
(2)已知某温度下,反应2SO2+O22SO3,的平衡常数K=19
在该温度下的体积固定的密闭容器中,c0(SO2)=1mol·L-1,c0(O2)=1 mol·L-1,当反应在该温度下SO2转化率为80%时,该反应__________(填“是”或“否”)达到化学平衡状态,若未达到,向_________(填“正反应”或“逆反应”) 方向进行。
(3)对于可逆反应:aA(g) +bB(g) ![]() cC(g)+dD(g) △H = a kJ·mol-1;若a+b>c+d,减小压强平衡向_______(填“正反应”或“逆反应”)方向移动;若升高温度,平衡向逆反应方向移动,则a_______0(填“>”或“<”)
cC(g)+dD(g) △H = a kJ·mol-1;若a+b>c+d,减小压强平衡向_______(填“正反应”或“逆反应”)方向移动;若升高温度,平衡向逆反应方向移动,则a_______0(填“>”或“<”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将1mol的CO和1mol水蒸气通入容器中发生下述反应:
CO+H2O![]() CO2+H2,达到平衡后,测得CO2为0.6mol,再通入0.4mol水蒸气,又达到平衡后,CO2的物质的量为
CO2+H2,达到平衡后,测得CO2为0.6mol,再通入0.4mol水蒸气,又达到平衡后,CO2的物质的量为
A. 等于0.6mol B. 等于1mol
C. 大于0.6mol且小于1mol D. 大于1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气污染物NO通常用含Ce4+的溶液吸收,生成HNO2、NO3-,再利用电解法将上述吸收液中的HNO2转化为无毒物质,同时生成Ce4+,其原理如图所示。下列说法正确的是

A. H+由右室进入左室
B. Ce4+从电解槽的c口流出,且可循环使用
C. 阴极的电极反应式:2HNO2+6H++6e-===N2↑+4H2O
D. 若用甲烷燃料电池作为电源,当消耗标准状况下33.6 L甲烷时,理论上可转化2mol HNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是__________。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.2H2(g)+O2(g)=2H2O(1) △H<0
C.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
(2) 以KOH溶液为电解质溶液,依据题(1)所选反应设计一个原电池,其负极的电极反应式为_______。

(3) 电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与右图中电解池相连,其中a为电解液,X和Y均为惰性电极,则:
①若a为CuSO4溶液,则电解时的化学反应方程式为___________________。
②若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,当阳极产生的气体672 mL(标准状况下)时,溶液的c(H+) = _____(假设电解后溶液体积不变)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com