
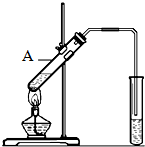
 乙酸是食醋的主要成分,它具有以下化学性质:
乙酸是食醋的主要成分,它具有以下化学性质:分析 (1)乙醇中官能团为-OH;
(2)乙酸中官能团为-COOH;
(3)乙酸与饱和碳酸钠溶液反应,乙酸乙酯与饱和碳酸钠溶液分层;
(4)乙醇与乙酸发生酯化反应生成乙酸乙酯和水.
解答 解:(1)乙醇中官能团为-OH,名称为羟基,故答案为:羟基;
(2)乙酸中官能团为-COOH,名称为羧基,故答案为:羧基;
(3)乙酸与饱和碳酸钠溶液反应,乙酸乙酯与饱和碳酸钠溶液分层,则除去乙酸乙酯中的乙酸用饱和碳酸钠溶液,分液可除杂,故答案为:饱和碳酸钠溶液;
(4)乙醇与乙酸发生酯化反应生成乙酸乙酯和水,反应为CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O,
故答案为:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意混合物分离提纯,题目难度不大.


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30.5 | B. | 26.3 | C. | 26 | D. | 24 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

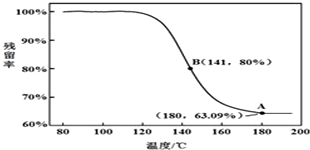
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
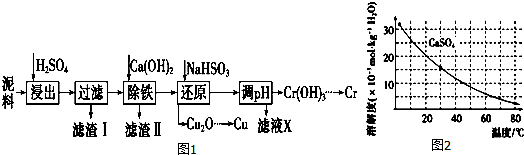
| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 乙酸是食醋的主要成分,它具有以下化学性质:
乙酸是食醋的主要成分,它具有以下化学性质:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
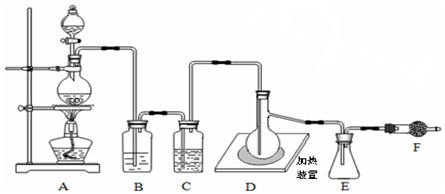
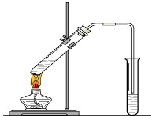 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Cl-、Na+、NO3- | B. | K+、Na+、NO3-、HCO3- | ||
| C. | Na+、Ba2+、Cl-、NO3- | D. | Fe3+、Na+、AlO2-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com