
| A. | 化学反应必然伴随发生能量变化 | |
| B. | 化学反应中能量变化的大小与反应物的状态有关 | |
| C. | 化学变化中的能量变化全部是由化学键变化引起的 | |
| D. | 能量变化是化学反应的基本特征之一 |
分析 A、所有化学反应均伴随着能量变化;
B、化学反应中的能量变化的大小与反应物的质量成正比,与反应物的状态有关;
C、化学变化中的能量变化主要是由化学键的断裂和形成引起的;
D、所有化学反应均伴随着能量变化,故能量变化是化学反应的基本特征之一.
解答 解:A、所有化学反应,都伴随着化学键的断裂与形成,均伴随着能量变化,故A正确;
B、化学反应中的能量变化的大小与反应物的质量成正比,与反应物的状态有关,故B正确;
C、断裂化学键要吸收能量,形成化学键要放出能量,化学变化中的能量变化主要是由化学键的断裂和形成引起的,故C错误;
D、所有化学反应均伴随着能量变化,故能量变化是化学反应的基本特征之一,故D正确.
故选C.
点评 本题考查了化学反应的基本特征和能量变化的原因,注意化学反应必然伴随着能量变化.


科目:高中化学 来源: 题型:解答题
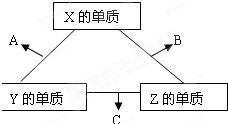
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
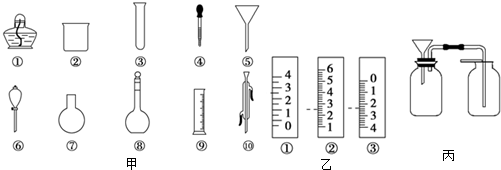
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 海水密度 | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+、Na+、Cu2+、Al3+ |
| 阴离子 | SO42-、HCO3-、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C、N、Si | B. | N、P、O | C. | N、O、S | D. | C、Si、S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸、纯碱、氣酸钾、氧化镁、二氧化硅 | |
| B. | 硝酸、烧碱、次氯酸钠、氧化钙、二氧化硫 | |
| C. | 次氯酸、消石灰、硫酸铵、过氧化钠、二氧化碳 | |
| D. | 氨基酸、过氧化钠、碱式碳酸铜、氧化铁、一氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 步骤序号 | 操作 | 实验现象 | 判 断 |
| ① | 取固体溶于水,得溶液X | 得到无色溶液 | |
| ② | 取少量溶液X,加入氯化钡溶液 | 生成白色沉淀 | 可能含有SO42-、SO32-、CO32- (填离子符号) |
| ③ | 取少量溶液X,加入浓氢氧化钠溶液,加热,并在试管口用湿润的红色石蕊试纸检验 | 试纸变蓝 | 含有NH4+ (填离子符号) |
| 结论:此白色固体可能是(NH4)2SO4或(NH4)2SO3或(NH4)2CO3. | |||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2和CH3CH2Cl都属于烃 | B. | 乙烯和乙烷都能发生加聚反应 | ||
| C. | C3H6有三种同分异构体 | D. | 苯的硝化反应属于取代反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com