
| ��� | �� | �� | �� | �� |
| pH | 11 | 11 | 3 | 3 |
| ��Һ | ��ˮ | ����������Һ | ������Һ | ���� |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��2H2(g)+O2(g)=2H2O(l)����H="-285.8" kJ/mol |
| B��H2(g)+1/2O2(g)=H2O(g)����H=-142.9kJ/mol |
| C��H2O(l)=H2(g)+1/2O2(g)�� ��H="+285.8" kJ/mol |
| D��2H2+O2=2H2O����H="-571.6" kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
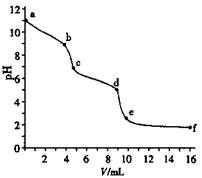
| A����Na2CO3��Һ��Ũ��Ϊ0.001 mol��L��1 |
| B����pH ="6" ʱ��c(Na+)>c(HCO3��)>c(CO32��) |
| C����pH ="7" ʱ��c(Na+)=c(Cl��) |
| D��c��d��������Ҫ���ӷ�Ӧ��CO32��+H+=HCO3�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A��a��ʱ����Һ�ʼ��ԣ���Һ��c(B+)>c(Cl-) |
| B��b��ʱ��Һ��pH=7 |
| C����c(Cl-)=c(B+)ʱ��V(HCl)<20mL |
| D��C��ʱ��Һ��c(H+)ԼΪ0.03mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������Һ��pH����7 | B�������Һ��pH����7 |
| C�������������ʵ������ | D�������Һ�������к����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
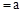 ��CH3COOHϡ��Һ��pH
��CH3COOHϡ��Һ��pH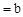 ��NaOHϡ��Һ�������ϣ������жϴ���
��NaOHϡ��Һ�������ϣ������жϴ���A������Ϻ�pH ���� ����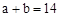 |
| B����Ӧ�����У�CH3COOH�ĵ�������� |
C������Ϻ�pH ����c ����c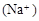 ��c ��c |
D������Ϻ�CH3COOH��NaOHǡ����ȫ��Ӧ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
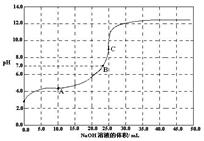
| A���ζ�ǰ������c(H+) ���ڼ���c(OH-) |
| B����A�㣬c(Na+) > c(X-)> c(HX)> c(H+)> c(OH-) |
| C����B�㣬����ǡ����ȫ��Ӧ |
| D����C�㣬c(X-) + c(HX) ="0.05" mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ʵ���� | c��HA��/ mo1��L��l | c��NaOH��/ mol��L��1 | ��Ӧ����ҺpH |
| �� | 0.1 | 0.1 | pH =9 |
| �� | c1 | 0.2 | pH =7 |
 H++A��
H++A���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��CH3COONaŨ��Һ | B��1mol?L��1��ˮ |
| C��1mol?L��1H2SO4 | D��2mol?L��1CH3COOH |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com