
n- 3 |
n- 3 |
 ,当生成5mol×71g/mol=355g的氯气时,转移的电子为10mol,当生成71克(1mol)Cl2生成,转移的电子为2mol,即2NA个,故答案为:
,当生成5mol×71g/mol=355g的氯气时,转移的电子为10mol,当生成71克(1mol)Cl2生成,转移的电子为2mol,即2NA个,故答案为: ;2NA;
;2NA; ,氧化产物是2molS,还原产物是1molS,所以氧化产物与还原产物的物质的量之比为2:1,故答案为:
,氧化产物是2molS,还原产物是1molS,所以氧化产物与还原产物的物质的量之比为2:1,故答案为: i;2:1;
i;2:1;

科目:高中化学 来源: 题型:
| A、溶液是电中性的,胶体是带电的 |
| B、可以用渗析的方法将胶体与溶液分离 |
| C、胶体中的分散质粒子大小在1~10nm之间 |
| D、向煮沸的稀氢氧化钠溶液中滴加饱和和FeC13溶液配制Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
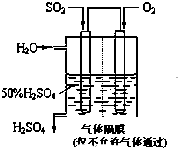 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.已知:
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.已知:| 1 |
| 2 |
| 10 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
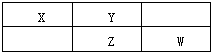 X、Y、Z、W为四种常见的短周期元素.其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如图所示:
X、Y、Z、W为四种常见的短周期元素.其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com