
科目:高中化学 来源: 题型:选择题
| A. |  盐桥中的K+移向ZnSO4溶液 | |
| B. | 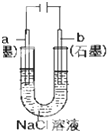 工作一段时间后,a极附近溶液的C(OH-)增大 | |
| C. | 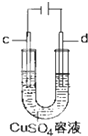 工作时,c极为发生氧化反应 | |
| D. |  电子由Zn流向Fe,装置中有Fe2+生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向饱和氯水中通入HCl,有c(H+)═c(Cl-)+c(OH-)+c(ClO-) | |
| B. | 氯气在1mol•L-1的NaCl溶液中比在1mol•L-1的AlCl3溶液中的溶解度小 | |
| C. | 光照,氯水的漂白性增强 | |
| D. | 若向饱和氯水中通入少量H2S,则$\frac{c({H}^{+})}{c(ClO^-)}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Fe(OH)2 |
| pH | 3.2 | 6.7 | 8.0 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有溴化银沉淀生成 | B. | 氯化银河溴化银沉淀等量生成 | ||
| C. | 氯化银沉淀多于溴化银沉淀 | D. | 氯化银沉淀少于溴化银沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何可逆反应都有一定的反应限度 | B. | 反应达到限度即停止了 | ||
| C. | 化学反应限度与时间的长短无关 | D. | 化学反应限度是可以改变的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com