
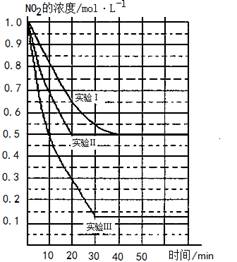
(11分)某条件下,在2L密闭容器中发生如下反应:2NO2(g)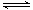 2NO(g)+O2(g) △H>0。在三种不同条件下进行,其中NO、O2的起始浓度都为0 mol/L,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。请回答下列问题:
2NO(g)+O2(g) △H>0。在三种不同条件下进行,其中NO、O2的起始浓度都为0 mol/L,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。请回答下列问题: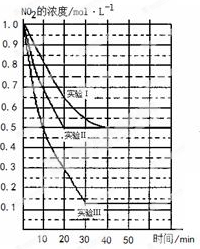
(1)请在图中标上对应的反应温度(800℃或850℃)。实验Ⅱ隐含的反应条件是_______________________。
(2)写出该反应的平衡常数表达式:K=______________。
(3)若实验Ⅰ中达平衡后,再向密闭容器中通入1mol NO2与1mol NO混合气体(保持温度不变),则平衡将 _________(填“正向移动”或“逆向移动”或“不移动”)
_________(填“正向移动”或“逆向移动”或“不移动”)
(4)一定条件下NO2与SO2可发生反应,其方程式为:
NO2(g)+SO2(g)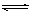 SO3(g)+NO(g) △H>0,将NO2与SO2以体积比
SO3(g)+NO(g) △H>0,将NO2与SO2以体积比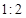 置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
A、体系压强保持不变 B、混合气体颜色保持不变
C、SO3和NO的体积比保持不变 D、混合气体的平均相对分子质量保持不变
(5)若改变条件,使平衡常数变大,该反应 。
A、一定向正反应方向移动 B、在平衡移动时,正反应速率先增大后减小
C、一定向逆反应方向移动 D、在平衡移动时,逆反应速率先增大后减小
(12分,每空2分)⑴使用了催化剂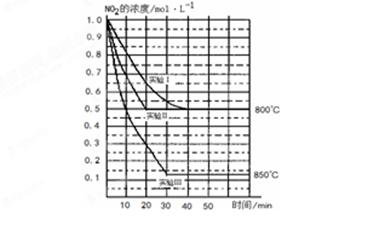
⑵c2(NO)·c (O2)/c2(NO2) ⑶不移动 ⑷B ⑸A B
解析试题分析:(1)由于正反应是吸热反应,所以升高温度平衡向正反应方向进行,则NO2的浓度降低,所以正确的图像是(见答案);实验Ⅱ和实验I相比,平衡状态是相同的,但达到平衡的时间减少,由于正反应是体积最大的,因此隐含的反应条件是使用铝催化剂。
(2)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值。所以根据反应的方程式可知,该反应的平衡常数表达式是K=c2(NO)·c (O2)/c2(NO2)。
(3)实验Ⅰ中达平衡后,c(NO2)=0.5mol/L,则
2NO2(g) 2NO(g)+O2(g)
2NO(g)+O2(g)
起始浓度(mol/L) 1 0 0
转化浓度(mol/L) 0.5 0.5 0.25
平衡浓度(mol/L): 0.5 0.5 0.25
所以平衡常数=c(NO)2×c(O2) c(NO2)2=0.25
若实验Ⅰ中达平衡后,再向密闭容器中通入1mol NO2与1mol NO混合气体(保持温度不变)
此时为c(NO2)=0.5mol/L+1mol/ 2L =1mol/L,c(NO)=+1mol/ 2L ="1mol/L" ,c(O2)=0.25mol/L,此时浓度商为Q=c(NO)2×c(O2) c(NO2)2 =12×0.25/ 12=0.25,所以平衡不移动。
(4)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。颜色深浅和浓度有关系,所以B正确。根据反应的方程式可知,反应前后体积不变,所以压强始终是不变的,A不正确;SO3和NO的体积比总是1︰1的,所以C不正确;混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量和物质的量都是不变的,所以D不正确,答案选B。
(5)改变条件,使平衡常数变大,则平衡一定是向正反应方向移动的,A正确,C不正确。由于正反应是吸热反应,所以改变的体积一定是升高温度,因此在平衡移动时,正反应速率先增大后减小,B正确。在平衡移动时,逆反应速率始终是增大的,答案选AB。
考点:考查物质的量或浓度随时间的变化曲线、化学平衡常数的含义和应用、外界条件对平衡的影响以及平衡状态的判断
点评:本题考查图象与化学平衡,明确影响化学平衡的因素及图象中量的是解答本题的关键,(3)是学生解答中的难点,要注意利用K与Q来分析平衡移动的方法。该题浓度较大,不易得分。


科目:高中化学 来源: 题型:
 某条件下,在2L密闭容器中发生如下反应2NO2(g)?2NO(g)+O2(g)
某条件下,在2L密闭容器中发生如下反应2NO2(g)?2NO(g)+O2(g)| c(NO)2×c(O2) |
| c(NO2)2 |
| c(NO)2×c(O2) |
| c(NO2)2 |
查看答案和解析>>
科目:高中化学 来源:2013届浙江省宁波市金兰合作组织高三上学期期中联考化学试卷(带解析) 题型:填空题
(12分)某条件下,在2L密闭容器中发生如下反应:2NO2(g) 2NO(g)+O2(g) △H>0。在三种不同条件下进行,其中NO、O2的起始浓度都为0 mol/L,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。
2NO(g)+O2(g) △H>0。在三种不同条件下进行,其中NO、O2的起始浓度都为0 mol/L,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。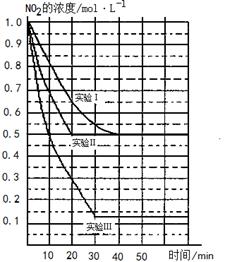
请回答下列问题:
(1)请在图中标上对应的反应温度(800℃或850℃)。实验Ⅱ隐含的反应条件是_______________________。
(2)写出该反应的平衡常数表达式:K=______________。
(3)若实验Ⅰ中达平衡后,再向密闭容器中通入1mol NO2与1mol NO混合气体(保持温度不变),则平衡将_________(填“正向移动”或“逆向移动”或“不移动”)
(4)一定条件下NO2与SO2可发生反应,其方程式为:
NO2(g)+SO2(g)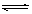 SO3(g)+NO(g) △H>0,将NO2与SO2以体积比
SO3(g)+NO(g) △H>0,将NO2与SO2以体积比 置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
A、体系压强保持不变 B、混合气体颜色保持不变
C、SO3和NO的体积比保持不变 D、混合气体的平均相对分子质量保持不变
(5)若改变条件,使平衡常数变大,该反应 。
A、一定向正反应方向移动 B、在平衡移动时,正反应速率先增大后减小
C、一定向逆反应方向移动 D、在平衡移动时,逆反应速率先增大后减小
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省临海市高三第三次段考化学试卷(解析版) 题型:填空题
(11分)某条件下,在2L密闭容器中发生如下反应:2NO2(g)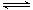 2NO(g)+O2(g) △H>0。在三种不同条件下进行,其中NO、O2的起始浓度都为0 mol/L,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。请回答下列问题:
2NO(g)+O2(g) △H>0。在三种不同条件下进行,其中NO、O2的起始浓度都为0 mol/L,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。请回答下列问题:
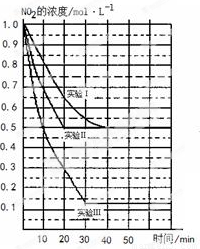
(1)请在图中标上对应的反应温度(800℃或850℃)。实验Ⅱ隐含的反应条件是_______________________。
(2)写出该反应的平衡常数表达式:K=______________。
|
|
|
 _________(填“正向移动”或“逆向移动”或“不移动”)
_________(填“正向移动”或“逆向移动”或“不移动”)
(4)一定条件下NO2与SO2可发生反应,其方程式为:
NO2(g)+SO2(g)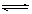 SO3(g)+NO(g) △H>0,将NO2与SO2以体积比
SO3(g)+NO(g) △H>0,将NO2与SO2以体积比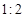 置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
A、体系压强保持不变 B、混合气体颜色保持不变
C、SO3和NO的体积比保持不变 D、混合气体的平均相对分子质量保持不变
(5)若改变条件,使平衡常数变大,该反应 。
A、一定向正反应方向移动 B、在平衡移动时,正反应速率先增大后减小
C、一定向逆反应方向移动 D、在平衡移动时,逆反应速率先增大后减小
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省宁波市金兰合作组织高三上学期期中联考化学试卷(解析版) 题型:填空题
(12分)某条件下,在2L密闭容器中发生如下反应:2NO2(g)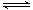 2NO(g)+O2(g)
△H>0。在三种不同条件下进行,其中NO、O2的起始浓度都为0 mol/L,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。
2NO(g)+O2(g)
△H>0。在三种不同条件下进行,其中NO、O2的起始浓度都为0 mol/L,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。
请回答下列问题:
(1)请在图中标上对应的反应温度(800℃或850℃)。实验Ⅱ隐含的反应条件是_______________________。
(2)写出该反应的平衡常数表达式:K=______________。
(3)若实验Ⅰ中达平衡后,再向密闭容器中通入1mol NO2与1mol NO混合气体(保持温度不变),则平衡将_________(填“正向移动”或“逆向移动”或“不移动”)
(4)一定条件下NO2与SO2可发生反应,其方程式为:
NO2(g)+SO2(g)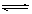 SO3(g)+NO(g) △H>0,将NO2与SO2以体积比
SO3(g)+NO(g) △H>0,将NO2与SO2以体积比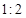 置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
A、体系压强保持不变 B、混合气体颜色保持不变
C、SO3和NO的体积比保持不变 D、混合气体的平均相对分子质量保持不变
(5)若改变条件,使平衡常数变大,该反应 。
A、一定向正反应方向移动 B、在平衡移动时,正反应速率先增大后减小
C、一定向逆反应方向移动 D、在平衡移动时,逆反应速率先增大后减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com