
【题目】高氯酸是一种酸性极强的无机含氧酸,可用于制备高氯酸盐、人造金刚石提纯等方面。查阅资料得到以下有关高氯酸的信息:
名称 | 分子式 | 外观 | 沸点 |
高氯酸 | HClO4 | 无色液体 | 130℃ |
工业上生产高氯酸的同时还生产了亚氯酸钠,工业流程如下:

(1)操作①的名称是____________,操作②的名称是___________。
(2)反应器Ⅰ中发生反应的化学方程式为________________________。
(3)反应器Ⅱ中发生反应的离子方程式为__________________________。
(4)若反应器Ⅱ中SO2以H2O2代替也可达到同样的目,此时发生反应的离子方程式为___________。
(5)若想得到201kg的HClO4纯品,至少需要NaClO3_________kg。
(6)工业上也可用铂作阳极、铜作阴极电解盐酸制得高氯酸,在阳极区可得到20%的高氯酸。写出阳极的电极反应式(其中盐酸与高氯酸以化学式出现)______________________________。
【答案】 过滤 蒸馏 3NaClO3+3H2SO4(浓)= HC1O4+2ClO2↑+3NaHSO4+H2O 4OH-+SO2+2ClO2=2ClO2-+SO42-+2H2O 2ClO2+2OH-+H2O=2ClO2-+O2+2H2O 639kg 4H2O+HCl-8e-=HClO4+8H+
【解析】本题考查化学工艺流程,涉及实验基本操作、化学反应方程式的书写、化学计算等知识,(1)根据流程,操作①得到晶体和滤液,因此操作①为过滤;操作②从溶液中得到高氯酸,根据信息,高氯酸是液体,沸点在130℃,因此操作②是蒸馏;(2)反应器I中加入NaClO3和浓硫酸,得到ClO2、NaHSO4、HClO4,大概形式为NaClO3+H2SO4→ClO2↑+NaHSO4+HClO4,根据化合价的升降法进行配平,得出:3NaClO3+3H2SO4→2ClO2↑+3NaHSO4+HClO4,产物中缺少2个氢原子和1个氧原子,即少了1个H2O,化学反应方程式为3NaClO3+3H2SO4(浓)= HC1O4+2ClO2↑+3NaHSO4+H2O ;(3)根据流程,ClO2中Cl显+4价,转变成NaClO2,其中Cl显+3价,显然SO2作还原剂,SO2用H2O2代替,H2O2作还原剂,被氧化成氧气,根据化合价的升降、原子守恒、所带电荷守恒进行配平,离子反应方程式为4OH-+SO2+2ClO2=2ClO2-+SO42-+2H2O;(5)根据(2)中反应方程式,3NaClO3~HClO4,因此m(NaClO3)=201×3×106.5/100.5kg=639kg;(6)根据电解原理,阳极上发生氧化反应,化合价升高,阳极反应式为4H2O+HCl-8e-=HClO4+8H+。


科目:高中化学 来源: 题型:
【题目】工业上制备BaCl2的工艺流程图如图:
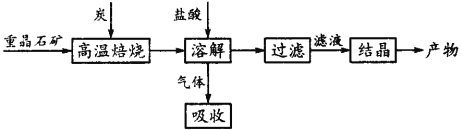
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得:
BaSO4(s)+4C(s)![]() 4CO(g)+BaS(s) ΔH1=+571.2kJ·mol-1①
4CO(g)+BaS(s) ΔH1=+571.2kJ·mol-1①
BaSO4(s)+2C(s)![]() 2CO2(g)+BaS(s) ΔH2=+226.2kJ·mol-1②
2CO2(g)+BaS(s) ΔH2=+226.2kJ·mol-1②
(1)气体用过量的NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为____________。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,![]() ________________。
________________。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反应C(s)+CO2(g) ![]() 2CO(g)的ΔH=____________kJ·mol-1。
2CO(g)的ΔH=____________kJ·mol-1。
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于敞口容器中的化学反应:Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g),下列叙述中不正确的是( )

A. Zn和H2SO4的总能量大于ZnSO4和H2的总能量
B. 反应过程中能量关系可用上图表示
C. 若将该反应设计成原电池,则Zn为负极
D. 若将该反应设计成原电池,当有32.5g锌溶解时正极放出11.2 L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率的说法正确的是( )
A. 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B. 2mol/ L100ml的盐酸和锌片反应,加入适量的氯化钠溶液,反应速率不变
C. SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢
D. 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作正确的是
A. 用pH试纸测得某新制氯水的pH值为3.5
B. 用酸式滴定管量取酸性高锰酸钾溶液5.10mL
C. 用标准盐酸溶液滴定一定体积的待测NaOH溶液时,用待测溶液润洗锥形瓶
D. 用l0 mL的量简量取8.05mL浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是
A. pH=l 的溶液中:Ba2+、Fe3+ 、Cl-、SCN-
B. 能使酚酞变红的溶液:Ca2+、K+、HCO3-、CO32-
C.  =10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
=10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
D. 由水电离的c(H+)=10-12mol·L-1的溶液中:Na+、Al3+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1 000 mL,其pH与溶液体积的关系如图19,下列说法正确的是( )
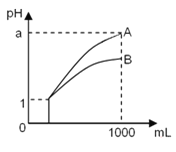
①若a<4,则A、B都是弱酸
②稀释后,A酸溶液的酸性比B酸溶液强
③若a=4,则A是强酸,B是弱酸
④A、B两种酸溶液的物质的量浓度一定相等
A.①④ B.②③ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把镁条投入到盛有盐酸的敞口容器里,产生H2的速率可由右图表示。在下列因素中:①盐酸的浓度;②镁条的表面积;③溶液的温度;④Cl-的浓度;影响反应速率的因素是

A. ①④ B. ③④ C. ①②③ D. ②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com