
分析 浓硫酸物质的量浓度=$\frac{1000ρω}{M}$,根据溶液稀释前后溶质的物质的量不变计算浓硫酸体积,量筒的规格应该等于或稍大于量取溶液体积.
解答 解:浓硫酸物质的量浓度=$\frac{1000ρω}{M}$=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,浓硫酸体积=$\frac{1.5mol/L×0.1L}{18.4mol/L}$=8.2mL,量筒的规格应该等于或稍大于量取溶液体积,所以应该选取10mL量筒,
故答案为:10mL;8.2.
点评 本题考查物质的量有关计算,为高频考点,侧重考查学生计算能力,正确计算浓硫酸浓度是解本题关键,易错点是量筒规格的选取,题目难度不大.


 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:解答题
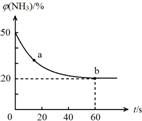 合理应用和处理氮的化合物,在生产生活中有重要意义.
合理应用和处理氮的化合物,在生产生活中有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl属于共价化合物,溶于水能电离出H+和Cl- | |
| B. | NaOH是离子化合物,该物质中只含离子键 | |
| C. | HI气体受热分解的过程中,只需克服分子间作用力 | |
| D. | 石英和干冰均为原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置.实验时按如下步骤操作:
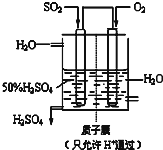
工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置.实验时按如下步骤操作: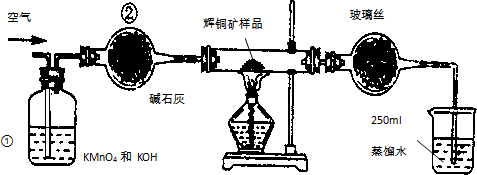
| 滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用铅蓄电池电解苦卤水(含C1-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极).下列说法中正确的是( )
用铅蓄电池电解苦卤水(含C1-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极).下列说法中正确的是( )| A. | 铅蓄电池放电时,该电池两极质量均减小 | |
| B. | 铅蓄电池充电时,B极应与外电源负极相连 | |
| C. | 电解苦卤水时,a电极首先放电的是Cl-而不是Br-,因为Cl-的还原性强于Br- | |
| D. | 当b极产生0.01 mol 气体时,铅蓄电池中消耗0.02 molH2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 离子 | Fe3+ | AP+ | ZrO2+ |
| 开始沉淀pH | 1.9 | 3.3 | 6.2 |
| 完仝沉淀pH | 3.2 | 5.2 | 8.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com