
下列各组中属于同位素的是( )。
A.40K与40Ca
B.35Cl2和37Cl2
C.D与T
D.金刚石与石墨
科目:高中化学 来源:2013-2014山东省日照市高三5月二模理综化学试卷(解析版) 题型:填空题
(17分)铁及其化合物在日常生活、生产中应用广泛。氯化铁和高铁酸钾都是常见的水处理剂。下图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程。
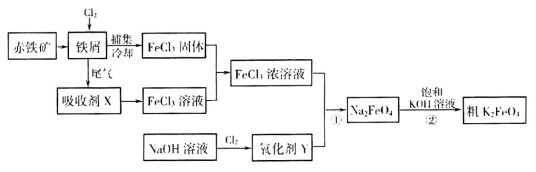
请回答下列问题
(1)已知:①Fe2O3(s)+3C(石墨) 2Fe(s)+3CO(g)△H=+489.0KJ·mol
2Fe(s)+3CO(g)△H=+489.0KJ·mol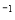 ;
;
②C(石墨)+CO2(g) 2CO(g)△H=+172.5KJ·mol
2CO(g)△H=+172.5KJ·mol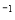 ;用赤铁矿为原料在高炉炼铁过程中发生的主要反应为Fe2O3(s)+3CO(g)
;用赤铁矿为原料在高炉炼铁过程中发生的主要反应为Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)△H= KJ·mol
2Fe(s)+3CO2(g)△H= KJ·mol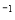 。
。
(2)吸收剂x的溶质为____________(写化学式)。
(3)氧化剂Y为“84消毒液”的有效成分,则在碱性条件下反应①的离子方程式为
__________________________________________________________________
(4)过程②是在某低温下进行的,反应的化学方程式为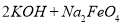 =
=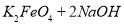 ,说明此温度下
,说明此温度下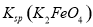 __________
__________ 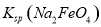 (填“>”或“<”)。
(填“>”或“<”)。
假定此过程中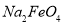 完全转化为
完全转化为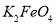 ,若最终制得粗产品
,若最终制得粗产品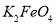 206.25t,产品纯度为96%,则理论上至少需要氧化剂Y的质量是___________t。
206.25t,产品纯度为96%,则理论上至少需要氧化剂Y的质量是___________t。
(5)高铁电池是一种新型二次电池,电解液为强碱溶液,其电池反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,放电时电池的负极反应式为______________________________________。
3Zn(OH)2+2Fe(OH)3+4KOH,放电时电池的负极反应式为______________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省兰陵县下学期期中考试高二化学试卷(解析版) 题型:选择题
下列各组物质,可以直接用分液漏斗分离的是: ( )
A.酒精和碘 B.硝基苯和水 C.乙醇和水 D.溴和溴苯
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省兰陵县下学期期中考试高一化学试卷(解析版) 题型:选择题
2012年1月,俄美科学家联合小组宣布合成出114号元素的一种同位素, 该同位素原子的质量数为298。以下叙述正确的是( )
A.该元素属于第六周期
B.该元素位于第ⅢA族
C.该元素为金属元素,性质与82Pb相似
D.该同位素原子含有114个电子,185个中子
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省兰陵县下学期期中考试高一化学试卷(解析版) 题型:选择题
X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,Z和Y 组成原电池时,Z为电池的负极。X、Y、Z三种金属的活动性顺序为( )。
A.X>Y>Z
B.X>Z>Y
C.Y>X>Z
D.Y>Z>X
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省乳山市下学期期中考试高一化学试卷(解析版) 题型:简答题
(11分)Ⅰ.分类法是化学学习的一种十分有效的方法,它可以使我们从不同角度对同一知识做更加深入的了解,人们根据不同的标准,即使同一物质也可能被划在不同的类别中。现有如下物质①MgCl2 ②HCl ③SO2 ④ NO2 ⑤K2CO3 ⑥ Cl2 ⑦CaO ⑧ NaOH
请根据下列标准,对上述物质进行分类:
(1)既含离子键又含共价键的物质是 (填代号,下同)。
(2)只含共价键且为非电解质的是 。
(3)含有共价键的化合物是 。
Ⅱ.向某恒容的密闭容器中加入A、B、C三种气体,如图所示是一定条件下三种气体的物质的量随时间的变化情况。

(1)写出该密闭容器发生反应的化学方程式为 。
(2)2分钟后A、B、C各物质的量不再随时间的
变化而变化,其原因是____ 。
(3)下列情况能说明该反应达到化学反应限度的是 。
A.该容器的压强不再发生变化;
B.单位时间内生成A的物质的量与生成C的物质的量相同;
C.该容器中气体的密度不再改变;
D.容器中A的物质的量与C的物质的量相同
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省乳山市下学期期中考试高一化学试卷(解析版) 题型:选择题
使0.15mol MnO2与过量的12mol·L-1的浓盐酸反应,使50mL 12mol·L-1的浓盐酸与足量MnO2反应,两者产生的氯气相比(其他条件相同)
A.一样多 B.前者较后者多 C.后者较前者多 D.无法比较
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省临沂市高三三模试卷理科综合化学试卷(解析版) 题型:选择题
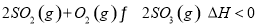 是制备硫酸的重要反应。下列说法正确的是
是制备硫酸的重要反应。下列说法正确的是
A.加入催化剂,反应速率加快,反应的 变大
变大
B.将平衡后的混合气体用浓硫酸吸收,剩余的气体只有
C.98%的浓硫酸用等体积的水稀释后,硫酸的质量分数为49%
D.若以稀硫酸为电解液,将该反应设计成原电池,放电过程中负极附近溶液的pH不断减小
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省东营市高三第二次模拟理科综合化学试卷(解析版) 题型:简答题
(20分) Ⅰ.(1)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,该反应的化学方程式为 ;
生成0.1molK2FeO4转移的电子的物质的量 mol。
(2)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:
3Zn+2K2FeO4+8H2O  3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
放电时电池的负极反应式为 。充电时电解液的pH (填“增大”“不变”或“减小”)。
Ⅱ.NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH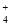 ) (填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH
) (填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH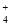 )。
)。
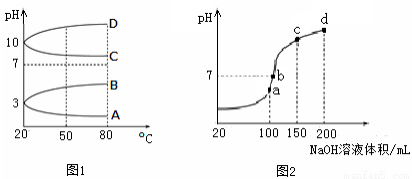
(2)如图1是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是 (填写字母);
②20℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO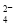 )-c(NH
)-c(NH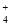 )-3c(Al3+)= mol·L-1。
)-3c(Al3+)= mol·L-1。
(3)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是 ;在b点,溶液中各离子浓度由大到小的排列顺序是 。
(4)已知Al(OH)3为难溶物(常温下,Ksp[Al(OH)3]=2.0×10-33)。当溶液pH=5时,某溶液中的
Al3+ (填“能”或“不能”)完全沉淀(溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀完全)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com