
【题目】下列处理方法中,正确的是
A. 做实验剩余的金属钠直接丢弃在废液缸中
B. 将过期的化学药品直接倒入下水道
C. 稀释浓硫酸时,将浓硫酸沿器壁缓慢注入水中并不断搅拌
D. 大量氯气泄漏时,迅速离开现场并尽量往低处去
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】某容积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:A+3B![]() 2C。若维持温度和压强不变,当达到平衡时,容器容积为VL,其中C气体的体积占10 % ,下列推断正确的是( )
2C。若维持温度和压强不变,当达到平衡时,容器容积为VL,其中C气体的体积占10 % ,下列推断正确的是( )
①原混合气体的体积为1.2L
②原混合气体的体积为1.1L
③反应达到平衡时气体A消耗掉0.05VL
④反应达到平衡时气体B消耗掉0.05VL
A.②③ B.②④ C.①③ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫—碘循环分解水制氢主要涉及下列反应:
Ⅰ SO2+2H2O+I2===H2SO4+2HI
Ⅱ 2HI![]() H2+I2
H2+I2
Ⅲ 2H2SO4===2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是____________。
a.反应Ⅲ易在常温下进行 b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O d.循环过程产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。

0~2 min内的平均反应速率v(HI)=____________。该温度下,H2(g)+I2(g)![]() 2HI(g)的平衡常数K=____________。
2HI(g)的平衡常数K=____________。
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡____________移动(填“向左”、“向右”或“不”);若加入少量下列试剂中的____________,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。
已知2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1
某氢氧燃料电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】试回答下列各题:
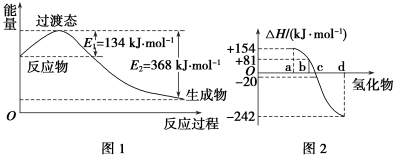
(1)如图1所示是NO2和CO反应生成CO2和NO过程中能量变化,写出NO2和CO反应的热化学方程式:____________________。
(2)化学反应的焓变与反应物和生成物的键能有关。
①已知:H2(g)+Cl2(g)===2HCl(g) ΔH=-185 kJ·mol-1
请填空:
共价键 | H—H | Cl—Cl | H—Cl |
键能/(kJ·mol-1) | 436 | 247 | ________ |
②图2中表示氧族元素中氧、硫、硒、碲生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写发生分解反应的热化学方程式:_______________________。
(3)已知:Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=-25 kJ·mol-1①
3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH=-47 kJ·mol-1②
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH=+19 kJ·mol-1③
请写出CO还原FeO的热化学方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3:物质结构与性质】
硼、碳、氮、氟、硫、铁等元素的化合物广泛存在于自然界,回答下列问题:
(1)基态铁原子的外围电子排布式为___________;Fe3+比Fe2+稳定的原因是___________。
(2)第二周期中,元素的第一电离能处于B与N之间的元素有___________种。
(3)NF3是微电子工业中优良的等离子刻蚀气体,NF3分子的空间构型为___________;在NF3中,N原子的杂化轨道类型为___________。
(4)与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为___________,层间作用力为___________。
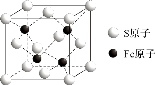
(5)S和Fe形成的某化合物,其晶胞如图所示,则该物质的化学式为___________。假设该晶胞的密度为ρ g/cm3,用NA表示阿伏加德罗常数,则该晶胞中距离最近的S原子之间的距离为(列出计算式即可)___________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用三个烧杯组成如图所示装置进行下列实验,实验结果与预测现象不一致的是( )
选项 | ①中物质 | ②中物质 | 预测现象 |
|
A . | 酚酞溶液 | 浓氨水 | ①中无色变红色 | |
B. | CCl4 | 液溴 | ①中变橙色 | |
C. | 浓氨水 | 浓硫酸 | 空气中产生白烟 | |
D. | NaAlO2溶液 | 浓硝酸 | ①中有白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据《荆楚岁时记》记载,五月的第一个午日是登高顺阳好天气之日,故五月初五称为“端午节”,粽子是大家熟悉的端午节庆食物。制作粽子会用到的部分原料有:①糯米、②蔗糖、③红枣、④鲜肉。请回答:
(1)富含淀粉的是______(填序号,下同)。
(2)富含蛋白质的是______。
(3)富含维生素C的是______。
(4)属于调味剂的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关浓H2SO4的叙述中,正确的是( )
A.浓H2SO4与铜片共热的反应中,浓H2SO4既表现出强氧化性,又表现出酸性
B.浓H2SO4与金属活动性顺序中氢后面的金属反应生成的气体一般为H2
C.常温下,铁或铝不与浓H2SO4反应,所以可用铁或铝制的容器贮存浓H2SO4
D.浓H2SO4是不挥发性强酸,氢硫酸是挥发性弱酸,所以可用浓H2SO4与FeS反应制取H2S气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.利用含锰废水(主要含Mn2+、SO42-、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工艺流程如下:
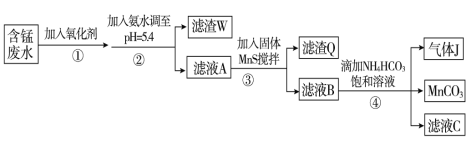
已知某些物质完全沉淀的pH如下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 | Mn(OH)2 | CuS | MnS | MnCO3 |
沉淀完全时的pH | 3.2 | 5.4 | 6.4 | 9.8[ | ≥0 | ≥7 | ≥7 |
回答下列问题:
(1)过程②中,所得滤渣W的主要成分是 。
(2)过程③中,发生反应的离子方程式是 。
(3)过程④中,若生成的气体J可使澄清石灰水变浑浊,则生成MnCO3的反应的离子方程
式是 。
(4)由MnCO3可制得重要的催化剂MnO2:2MnCO3+O2=2MnO2+2CO2。现在空气中加热460.0 g MnCO3,得到332.0 g产品,若产品中杂质只有MnO,则该产品中MnO2的质量分数是 (用百分数表示,小数点后保留1位小数)。
Ⅱ.常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
(1)上述盐溶液中的阴离子,结合H+能力最强的是 。
(2)根据表中数据判断,浓度均为0.01 mol·L-1的下列物质的溶液中,酸性最强的是 (填序号)。
A.HCN
B.HClO
C.C6H5OH
D.CH3COOH
E.H2CO3
(3)根据上表数据,请你判断下列反应不能成立的是 (填序号)。
A.HCN+Na2CO3=NaHCO3+NaCN
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
D.CH3COONa+HClO=NaClO+CH3COOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com