
【题目】现有A、B、C、D、E、F、G七种元素,其中 A、B、C、D、E、F为短周期元素且原子序数依次增大;A的最高正价与最低负代数和为零;B的最高价氧化物与C的氢化物在水中反应得到的生成物X既可与酸反应又可与碱反应;常温下D2是气体,标况时D2气体的密度约是1.43g/L;E原子半径在同周期中除稀有气体外最大, F原子M层上的电子比K层多5个。金属G的合金在生活中用量最大,用途最广。
(1)G在元素周期表中的位置是_________,画出F的离子结构示意图____________
(2)D、E、F离子半径由大到小顺序为:___________________(用离子符号表示)
(3)A与D可形成原子个数比为1:1的化合物,用电子式表示该化合物的形成过程_________________________
(4)D与E形成某离子化合物H具有漂白性,写出H的电子式_______________,该化合物和B与D形成的某化合物反应的化学方程式为:_______________,1molH发生该反应转移电子数为_____________
(5)若X为正盐,X中含有的化学键类型为_______________,写出加热该盐的化学方程式:_______________
(6)B和F两种元素相比较,原子得电子能力较强的为_______________,以下三种说法中,可以验证B和F得电子能力强弱的是_______________(填写编号);
a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,F元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(7)金属元素G可与F形成化合物GF3。将G的单质与石墨用导线相连浸入GF3溶液中形成一个原电池。该原电池工作时,石墨一极发生的反应可以表示为___________,当有1.2mol e-转移时单质G质量变化为___________g
(8)用A元素的单质与D元素的常见单质可以制成电池,电池中装有KOH浓溶液,用多孔的惰性电极甲和乙浸入KOH溶液,在甲极通入A的单质,乙极通入D的单质,则甲极的电极反应式为:___________________。
【答案】(1)第四周期,第Ⅷ族;![]()
(2)Cl->O2->Na+
(3)![]()
(4)![]() ;2Na2O2+2CO2=2Na2CO3+O2(1分)6.02*1023
;2Na2O2+2CO2=2Na2CO3+O2(1分)6.02*1023
(5)离子键、共价键(NH4)2CO3 ![]() 2NH3↑+H2O+CO2↑
2NH3↑+H2O+CO2↑
(6)Cl(1分)bc(1分)
(7)2Fe3++2e-= 2Fe2+ ;33.6
(8)H2– 2e-+ 2OH-=" 2" H2O
【解析】试题分析:A、B、C、D、E、F为短周期元素且原子序数依次增大,常温下D2是气体,标况时D2气体的密度约是1.43g/L,则其相对分子质量为1.43×22.4=32,则D为O元素;A的最高正价与最低负代数和为零,则A处于ⅠA族或ⅣA族,原子序数比氧的至少小3,故A为氢元素;B的最高价氧化物与C的氢化物在水中反应得到的生成物X既可与酸反应又可与碱反应,B、C原子序数都小于氧,故X为碳酸的铵盐,可能为正盐碳酸铵或酸式盐碳酸氢铵,则B为碳元素、C为N元素;E原子半径在同周期中除稀有气体外最大,处于IA族,原子序数大于氧,则E为Na;F原子M层上的电子比K层多5个,最外层电子数为7,故F为Cl元素;G的合金在生活中用量最大,用途最广,该合金为钢,则G为Fe元素。
(1)G为Fe,在元素周期表中的位置是:第四周期第Ⅷ族,F为Cl,离子结构示意图为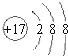 ,故答案为:第四周期第Ⅷ族;
,故答案为:第四周期第Ⅷ族;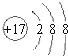 ;
;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故D、E、F离子半径由大到小顺序为:Cl->O2->Na+,故答案为:Cl->O2->Na+;
(3)A与D可形成原子个数比为1:1的化合物为H2O2,用电子式表示该化合物的形成过程:![]() ,故答案为:
,故答案为:![]() ;
;
(4)D与E形成某离子化合物H具有漂白性,则H为Na2O2,电子式为![]() ,该化合物和B与D形成的某化合物反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,1mol过氧化钠发生该反应生成0.5mol氧气,转移1mol电子,故转移电子数为6.02×1023 ,故答案为:
,该化合物和B与D形成的某化合物反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,1mol过氧化钠发生该反应生成0.5mol氧气,转移1mol电子,故转移电子数为6.02×1023 ,故答案为:![]() ;2Na2O2+2CO2=2Na2CO3+O2;6.02×1023 ;
;2Na2O2+2CO2=2Na2CO3+O2;6.02×1023 ;
(5)X为正盐,则X为碳酸铵,含有离子键、共价键,碳酸铵加热分解生成氨气、二氧化碳气体和水,反应的化学方程式为:(NH4)2CO3![]() 2NH3↑+H2O+CO2↑,故答案为:离子键、共价键; (NH4)2CO3
2NH3↑+H2O+CO2↑,故答案为:离子键、共价键; (NH4)2CO3![]() 2NH3↑+H2O+CO2↑;
2NH3↑+H2O+CO2↑;
(6)碳和氯两种元素相比较,原子得电子能力较强的为氯,a.单质的沸点属于物理性质,不能比较得电子能力强弱,故a错误;b.二者形成的化合物中,F(氯)元素的原子显负价,说明氯元素对键合电子吸引更强,则Cl原子得电子能力更强,故b正确;c.非金属性与氢化物稳定性一致,非金属性越强,得电子能力越强,故c正确,故答案为:Cl;bc;
(7)金属元素G可与F形成化合物FeCl3.将Fe的单质与石墨用导线相连浸入FeCl3溶液中形成一个原电池,该原电池工作时,石墨为正极,发生还原反应,电极反应式为:2Fe3++2e-═2Fe2+,根据电子转移守恒,当有1.2mol e-转移时,参加反应的Fe为![]() =0.6mol,故单质Fe质量变化为0.6mol×56g/mol=33.6g故答案为:2Fe3++2e-═2Fe2+;33.6;
=0.6mol,故单质Fe质量变化为0.6mol×56g/mol=33.6g故答案为:2Fe3++2e-═2Fe2+;33.6;
(8)氢气、氧气制成电池,电池中装有KOH浓溶液,氢气发生氧化反应、氧气发生还原反应,在甲极通入氢气,乙极通入氧气,则甲为负极,乙为正极,甲极上是氢气失去电子,碱性条件下生成水,电极反应式为:H2-2e-+2OH-="2" H2O,故答案为:H2-2e-+2OH-="2" H2O。


科目:高中化学 来源: 题型:
【题目】2015年,我国科学家屠呦呦因发现青蒿素而荣获诺贝尔奖。由青蒿素合成衍生药物蒿甲醚的合成路线如下:

A.①、②反应依次为加成反应、取代反应
B.上述三种有机物的含氧官能团完全相同
C.青蒿素因含酯基具有氧化性和杀菌功能
D.蒿甲醚的化学式为C16H24O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]秸秆(含多糖类物质)的综合应用具有重要的意义。下面是以秸秆为原料合成聚酯类高分子化合物的路线:

回答下列问题:
(1)下列关于糖类的说法正确的是______________。(填标号)
a.糖类都有甜味,具有CnH2mOm的通式
b.麦芽糖水解生成互为同分异构体的葡萄糖和果糖
c.用银镜反应不能判断淀粉水解是否完全
d.淀粉和纤维素都属于多糖类天然高分子化合物
(2)B生成C的反应类型为______。
(3)D中官能团名称为______,D生成E的反应类型为______。
(4)F 的化学名称是______,由F生成G的化学方程式为______。
(5)具有一种官能团的二取代芳香化合物W是E的同分异构体,0.5 mol W与足量碳酸氢钠溶液反应生成44 g CO2,W共有______种(不含立体结构),其中核磁共振氢谱为三组峰的结构简式为_________。
(6)参照上述合成路线,以(反,反)-2,4-己二烯和C2H4为原料(无机试剂任选),设计制备对二苯二甲酸的合成路线_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组的同学用滴定法对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定。实验步骤如下,回答下列问题:
(1)用分析天平准确称取该样品5.000g,全部溶于水配制成1000.0mL的溶液。用 (填一仪器名称)量取其中20.00mL放在锥形瓶中,滴加几滴指示剂,待测。
(2)用浓度为0.1000mol/L的盐酸标准溶液进行滴定。滴定管在使用前应先检漏、洗涤、 、正式装液,排除气泡并调节液面。
(3)滴定过程中,锥形瓶中溶液的pH变化如下

下表是几种酸碱指示剂的变色范围,根据以上信息分析,上述中和滴定中可选用的指示剂是 ,滴定终点的现象是 。(如有几种,可任填一种)

(4)样品中,NaOH的质量百分含量为 。若滴定前滴定管尖嘴部分有气泡,滴定终了没有气泡,则会造成计算值 (填“偏大”、“偏小”或“无法确定”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2=CHCHO)和乙腈(CH3CN)等,回答下列问题:
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:
①C3H6(g)+NH3(g)+ 3/2O2(g)=C3H3N(g)+3H2O(g) ΔH=-515kJ/mol
①C3H6(g)+ O2(g)=C3H4O(g)+H2O(g) ΔH=-353kJ/mol
两个反应在热力学上趋势均很大,其原因是________;有利于提高丙烯腈平衡产率的反应条件是________;提高丙烯腈反应选择性的关键因素是________。
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应温度为460℃。低于460℃时,丙烯腈的产率________(填“是”或者“不是”)对应温度下的平衡产率,判断理由是________;高于460℃时,丙烯腈产率降低的可能原因是________(双选,填标号)
A.催化剂活性降低 | B.平衡常数变大 | C.副反应增多 | D.反应活化能增大 |
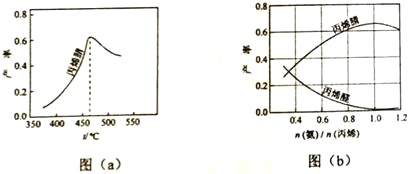
(3)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示。由图可知,最佳n(氨)/n(丙烯)约为,理由是_______________。进料氨、空气、丙烯的理论体积约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:_______与盐酸反应最剧烈,______与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理_______说明理由:_____________________________。
Ⅱ.利用下图装置可以验证非金属性的变化规律。
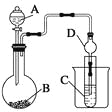
(3)仪器A的名称为____,干燥管D的作用是______________。
(4) 实验验证氯的非金属性大于硫:A中放浓盐酸、B中放KMnO4、C中盛放__________,离子方程式为____________。从环境保护的观点考虑,此装置缺少尾气处理装置,可用________溶液吸收尾气.
(5)若要证明非金属性:C>Si,则A中加盐酸、B中加Na2CO3、C中加________,观察到C中溶液的现象为____________________。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有________溶液的洗气瓶.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳豆是一种减肥食品,从其中分离出一种由C、H、O三种元素组成的有机物A,为确定其结构现进行如下实验:
①相同条件下,测得A的蒸气密度是H2密度的60倍
②6gA在一定条件下完全燃烧,生成3.36L二氧化碳(标况)和1.8g水
③1mol物质A发生酯化反应,转化完全时消耗乙醇92g,等量的A能与足量的金属钠反应放出33.6L氢气(标况)试计算确定: (写过程)
(1)A的分子式____________________
(2)A的结构简式________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A(C10H20O2)具有兰花香味,可用做香皂、洗发香波的芳香赋予剂。
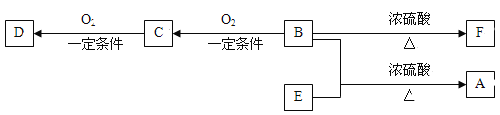
已知:①B分子中没有支链。
②D能与碳酸氢钠溶液反应放出二氧化碳。
③D、E互为具有相同官能团的同分异构体。E分子烃基上的氢若被氯原子取代,其一氯代物只有一种。
④F可以使溴的四氯化碳溶液褪色。
(1)B可以发生的反应有 (选填序号)。
a、取代反应 b、消去反应 c、加聚反应 d、氧化反应
(2)C、D、F分子所含的官能团的名称依次是
(3)写出E的结构简式:
(4)写出C→D的化学方程式:
(5)写出B→F的化学方程式:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com