
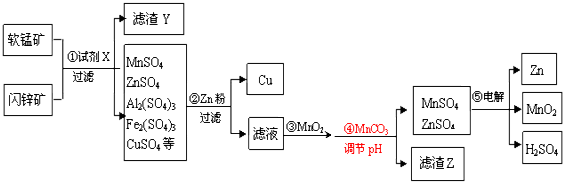
分析 以软锰矿(主要成份为MnO2和SiO2,含少量Al2O3)和闪锌矿(主要成份ZnS和SiO2,含少量FeS、CuS)为原料生产MnO2、锌及副产品Cu,软锰矿和闪锌矿粉碎后加入试剂X为硫酸酸溶后得到滤渣Y为S、SiO2,得到滤液主要含有MnSO4、ZnSO4、Al2(SO4)3、Fe2(SO4)3、CuSO4等,加入过量的锌粉过滤得到滤渣为Cu、Zn,滤液为MnSO4、ZnSO4、Al2(SO4)3、FeSO4,加入MnO2氧化亚铁离子为铁离子,加入MnCO3调节溶液PH沉淀铝离子、铁离子、锌离子和部分锰离子,过滤得到沉淀主要为MnCO3、ZnCO3、Al(OH)3 Fe(OH)3、滤液为MnSO4、ZnSO4,电解混合溶液得到Zn、MnO2、H2SO4,据此分析判断,
解答 解:(1)分析可知X为H2SO4,
故答案为:H2SO4;
(2)MnO2具有强氧化性,硫离子被也会为硫单质,滤渣Y中含有一种单质为S,步骤③MnO2的作用是将Fe2+氧化为Fe3+,
故答案为:S;将Fe2+氧化为Fe3+;
(3)步骤②加Zn粉时,Zn与Fe2(SO4)3溶液反应的离子方程式为:Zn+2Fe3+═Zn2++2Fe2+,
故答案为:Zn+2Fe3+═Zn2++2Fe2+;
(4)步骤④发生反应的离子方程式为:MnCO3+2H+═Mn2++CO2↑+H2O,
故答案为:MnCO3+2H+═Mn2++CO2↑+H2O;
(5)调节pH用MnCO3而不用MnS的原因是:Ksp[ZnS]=2×10-22,Ksp[MnS]=2×10-10,Ksp[ZnCO3]=1.4×10-11,Ksp[MnCO3]=1.8×10-11,硫化锌的溶度积较小,若加入MnS调节pH时,可能会使锌离子转化成硫化锌沉淀,
故答案为:硫化锌的溶度积较小,若加入MnS调节pH时,可能会使锌离子转化成硫化锌沉淀;
(6)滤渣Z除MnCO3、ZnCO3外,主要成分为Al(OH)3;Fe(OH)3,
故答案为:Al(OH)3;Fe(OH)3;
(7)电解MnSO4、ZnSO4混合溶液,阳极电极反应Mn2+-2e-+2H2O=MnO2+4H+,阴极电极反应为Zn2++2e-=Zn,电子守恒得到步骤⑤的电解产物Zn、MnO2、H2SO4的物质的量之比是1:1:2,
故答案为:1:1:2.
点评 本题考查了物质分离提纯的实验过程分析、物质性质、离子沉淀条件、氧化还原反应的应用、电极原理等知识点,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Mg(OH)2+2HCl═MgCl2+2H2O | B. | 2NaOH+H2SO4═Na2SO4+2H2O | ||
| C. | Ba(OH)2+H2SO4═BaSO4↓+2H2O | D. | CH3COOH+NaOH═CH3COONa+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中电能转化为化学能 | |
| B. | 反应低温可以自发转化 | |
| C. | 上述反应若使用催化剂,能改变反应的△H | |
| D. | 反应CH4(g)=C(s)+2H2(g)的△H=74.8kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | lmol Cl2与足量的铁充分反应,.转移的电子数为2NA | |
| B. | 标准状况下,11.2L水所含分子数为0.5NA | |
| C. | 常温常压下,22.4L氖气含有NA个氖原子 | |
| D. | 124g Na2O溶于水后所得溶液中含有O2-离子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
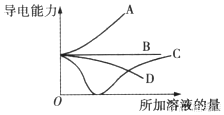
| A. | 曲线A表示NaOH溶液中滴加稀盐酸 | |
| B. | 曲线B表示CH3COOH溶液中滴加KOH溶液 | |
| C. | 曲线C表示Ba(OH)2溶液中滴加稀硫酸 | |
| D. | 曲线D表示Cu(OH)2悬浊液中滴加HNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫单质有氧化性 | B. | 二氧化硫具有还原性 | ||
| C. | 硫酸可以被氧化 | D. | 硫化氢(H2S)可以被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 银白色金属 | B. | 不与氧气反应 | ||
| C. | 能发生铝热反应 | D. | 能与氢氧化钠溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com