
通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是 ( )。
| 操作、现象 | 解释 | |
| A | 向KI淀粉溶液中加入FeCl3溶液,溶液变蓝 | Fe3+能与淀粉发生显色反应 |
| B | 把生铁放置于潮湿的空气中,铁表面有一层红棕色的斑点 | 铁在潮湿的空气中易生成Fe(OH)3 |
| C | 向稀硝酸中加入少量铁粉,有气泡产生 | 说明Fe置换出硝酸中的氢,生成了氢气 |
| D | 新制Fe(OH)2露置于空气中一段时间,白色物质变成了红褐色 | 说明Fe(OH)2易被O2氧化成Fe(OH)3 |
科目:高中化学 来源: 题型:
溴化碘(IBr)的化学性质与卤素单质相似,能与大多数金属反应生成金属卤化物,和某些非金属单质反应生成相应的卤化物,跟水反应的方程式为IBr+H2O===HBr+HIO,下列有关IBr的叙述中,不正确的是 ( )。
A.IBr是双原子分子
B.在很多反应中,IBr是强氧化剂
C.和NaOH溶液反应生成NaBr和NaIO
D.和水反应时,既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
下列图像能表示相关反应中生成物物质的量的变化的是(横、纵坐标单位:mol) ( )。
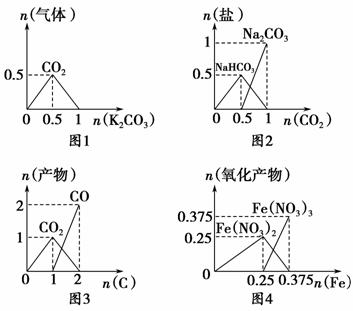
A.图1:n(HCl)=1 mol,K2CO3加入到HCl溶液中,在敞口容器中生成的气体
B.图2:n(NaOH)=1 mol,CO2通入到NaOH溶液中反应生成的盐
C.图3:n(O2)=1 mol,高温下C和O2在密闭容器中的生成物
D.图4:n(HNO3)=1 mol,Fe和稀HNO3反应生成的氧化产物(还原产物为NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
部分氧化的FeCu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:
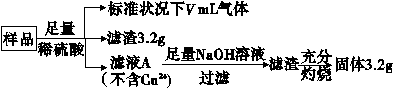
下列说法正确的是 ( )。
A.滤液A中的阳离子为Fe2+、Fe3+、H+
B.样品中Fe元素的质量为2.24 g
C.样品中CuO的质量为4.0 g
D.V=896 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
如图两圆相交部分A、B、C、D分别表示两物质间的反应。下列各对应反应的离子方程式书写不正确的是 ( )。
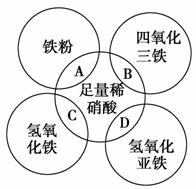
A.Fe+4H++NO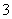 ===Fe3++NO↑+2H2O
===Fe3++NO↑+2H2O
B.Fe3O4+8H+===Fe2++2Fe3++4H2O
C.Fe(OH)3+3H+===Fe3++3H2O
D.3Fe(OH)2+10H++NO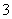 ===3Fe3++NO↑+8H2O
===3Fe3++NO↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是 ( )。
A.Al B.Al(OH)3
C.AlCl3 D.Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有大量的Mg2+、Al3+、H+、Cl-和少量OH-,向该溶液中逐滴加入0.5 mol·L-1 NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积之间的关系如下图所示,则可判断原溶液中 ( )。
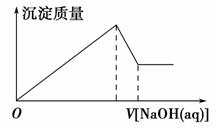
A.有Mg2+,没有Al3+ B.有Al3+,没有Mg2+
C.有Mg2+和Al3+ D.有大量的H+、Mg2+和Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
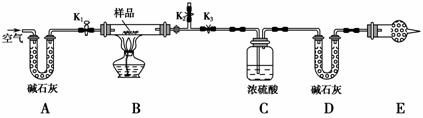
有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。
(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是____________________。
②称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是______________________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为________________________________________
____________________________________________________、
___________________________________________________。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是______________________ _______________________________________________________。
②E处干燥管中盛放的药品是________,其作用是___________________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量分数________(填“偏大”、“偏小”或“无影响”)。
③若样品质量为w g,反应后C、D装置增加的质量分别为m1 g、m2 g,则混合物中Na2CO3·10H2O的质量分数为________(用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
有Fe2+、NO—3、Fe3+、NH+4、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生 成物,下列叙述不正确的是
A.氧化剂与还原剂的物质的量之比为8:1
B.该过程说明Fe(NO—3)2溶液不宜加酸酸化
C.若有1 mol NO3发生还原反应,则转移8 mol e—
D.若把该反应设计为原电池,则负极反应为Fe2+一e—=Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com