
 ,实验室制取G的化学方程式为Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O.
,实验室制取G的化学方程式为Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O.| 化学键 | O=O(g) | H-H(g) | H-O(g) |
| 键能/kJ•mol-1 | 496 | x | 463 |
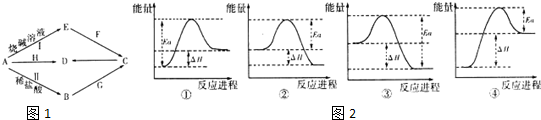
分析 F是一种温室气体,则F为二氧化碳气体;金属A能够与烧碱溶液、盐酸溶液反应,其中A与烧碱溶液生成的E溶液能够与二氧化碳反应,则A为Al;H是一种红褐色的氧化物,则H为Fe2O3;H能够与金属铝反应生成D,且B,C,D,E四种化合物中含有一种相同的元素,则D为氧化铝、C为氢氧化铝;B为氯化铝;气体G的水溶液为碱性,则G为氨气,据此进行解答.
解答 解:(1)氨气分子中氮原子最外层达到8电子稳定结构,漏掉了氮原子的一对孤电子对,所以氨气的电子式为: ;固体氯化铵和固体氢氧化钙反应的方程式为:Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O,故答案为:
;固体氯化铵和固体氢氧化钙反应的方程式为:Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O,故答案为: ;Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O;
;Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O;
(2)金属铝与氢氧化钠溶液反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)已知H2的燃烧热为286kJ•mol-1,故2mol氢气燃烧生成2mol液态水时放出热量为286kJ•mol-1×2=572kJ,
18g水蒸气变成液态水放出44kJ的热量,2mol液态水变为气态水吸收的热量为$\frac{2mol×18g/mol}{18g}$×44kJ=88kJ,
故2mol氢气燃烧生成2mol气态水时放出热量为:572kJ-88kJ=484kJ,
故热化学方程式为:2H2(g)+O2(g)=2H2O(g)△H=-484kJ/mol,
所以△A=反应物总键能-生成物总键能=2xkJ/mol+496kJ/mol-4×463kJ/mol=-484kJ/mol,
解得:x=436,
故答案为:436;
(4)A与H反应的化学方程式为Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,该反应是放热反应,生成物能量低于反应物能量,结合图象分析活化能数值大于反应焓变判断,故图②③符合,
故答案为:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;②③;
(5)H组成相似的另外一种具有磁性的物质为Fe3O4,在酸性条件下,H将TcO4-转化为难溶于水的TcO2,同时得到一种难溶于水的弱碱应为氢氧化铁,该反应的离子方程式为3Fe3O4+TcO4-+13H2O+H+=TcO2+9Fe(OH)3,
故答案为:3Fe3O4+TcO4-+13H2O+H+=TcO2+9Fe(OH)3.
点评 本题考查了无机推断,题目难度中等,侧重考查铝及其化合物性质,明确常见金属及其化合物性质为解答关键,注意掌握热化学方程式的焓变与键能之间的关系,试题培养了学生的分析能力及灵活应用能力.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | C2H5Br和NaOH溶液混合共热 | |
| B. | 乙醇和NaOH溶液混合共热 | |
| C. | 一溴丁烷与的NaOH的丁醇溶液混合共热 | |
| D. | 氯苯与NaOH溶液混合共热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作步骤 | 预期现象与结论 |
| 步骤1:观察样品 | 溶液呈蓝绿色,①不能(填“能”或“不能”)确定产物中铁元素的价态 |
| 步骤2:取少量溶液,滴加酸性KMnO4溶液 | ②若KMnO4溶液的紫红色褪去或变浅,则说明产物中含+2价铁元素,若KMnO4溶液不褪色或不变浅,则说明产物中不含+2价铁元素 |
| 步骤3:③另取少量溶液,滴加KSCN溶 | ③若溶液变为红色,说明产物中含+3价铁元素;若溶液颜色无明显变化,则说明产物中不含+3价的铁元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
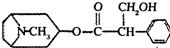
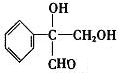 或
或 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
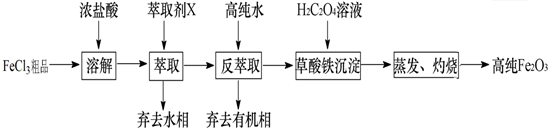
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熵增加且放热的反应一定是自发反应 | |
| B. | X?Y+Z正反应吸热,则逆反应必然放热 | |
| C. | 化学反应的焓变△H越大,表示放热越多 | |
| D. | 稀溶液中,酸碱中和反应生成1 mol H2O时放热不一定为57.3 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com