
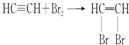
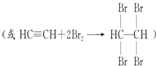
 .
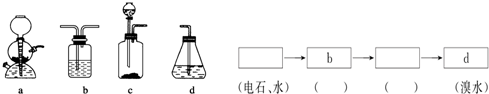
.
分析 (1)碳化钙能与水反应生成乙炔,乙炔具有不饱和键,能与溴水发生加成反应而使溴水褪色;
(2)生成的乙炔中混有硫化氢气体,可与溴水发生氧化还原反应而使溴水褪色;
(3)电石中含有硫化物,与水反应生成硫化氢气体;
(4)实现乙同学的方案应用硫酸铜溶液除去硫化氢并检验是否完全除尽,之后再用溴水检验是否生成乙炔;
(5)根据取代反应的特征是:有去有回来回答.
解答 解:(1)碳化钙能与水反应生成乙炔和水,反应方程式为CaC2+2H2O→Ca(OH)2+C2H2↑,乙炔具有不饱和键,能与溴水发生加成反应而使溴水褪色,反应方程式为: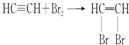
 ,
,
故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;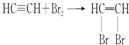
 ;
;
(2)生成的乙炔中混有硫化氢气体,可与溴水发生氧化还原反应而使溴水褪色,
故答案为:不能;ac;
(3)电石中含有硫化物,与水反应生成硫化氢气体,硫化氢气体具有还原性,能与溴水发生氧化还原反应生成硫和溴化氢,反应方程式为Br2+H2S═S↓+2HBr,
故答案为:H2S;Br2+H2S═S↓+2HBr;
(4)实现乙同学的方案应用硫酸铜溶液除去硫化氢并检验是否完全除尽,之后再用溴水检验是否生成乙炔,选择c做为发生装置,选择b作为除杂和检验装置,
故答案为: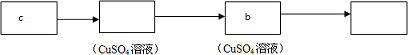
(5)为验证这一反应是加成而不是取代,丙同学提出可用pH试纸来测试反应后溶液的酸性,如若发生取代反应,必定生成HBr,溶液酸性将会明显增强,故可用pH试纸验证;
故答案为:如若发生取代反应,必定生成HBr,溶液酸性将会明显增强,故可用pH试纸验证.
点评 本题考查了乙炔的制备和性质实验,题目难度不大,本题中注意乙炔的除杂和性质实验,注意与溴水反应的性质.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:选择题
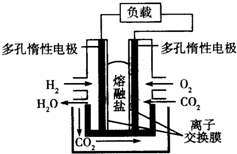
| A. | CO2在电池反应过程中不参与反应 | |
| B. | 电池总反应为2H2O═O2↑+2H2↑ | |
| C. | 该离子交换膜为阳离子交换膜 | |
| D. | 电池正极反应式为O2+2CO2+4e-═2CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:Z>X>W | |
| B. | 单质的沸点:Z>X | |
| C. | 原子的最外层电子数:Y>W>Z | |
| D. | 标准状况下,5.6LW的单质中含有0.5mol原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
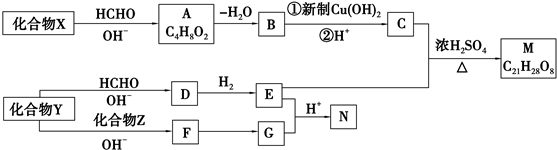
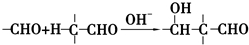
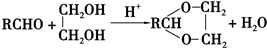
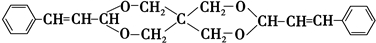
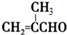 +2Cu(OH)2+NaOH$\stackrel{△}{→}$
+2Cu(OH)2+NaOH$\stackrel{△}{→}$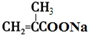 +Cu2O↓+3H2O.
+Cu2O↓+3H2O.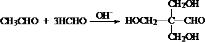 .
. 和
和 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随着元素原子序数的递增,原子最外层电子总是从1到8重复出现 | |
| B. | 随着元素原子序数的递增,同周期从左到右原子半径从小到大(稀有气体除外)发生周期性变化 | |
| C. | 随着元素原子序数的递增,元素最高正价从+1到+7、负价从-7到-1重复出现 | |
| D. | 元素原子核外电子排布的周期性变化是导致原子半径、元素主要化合价和元素性质周期性变化的主要原因 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸钙有强氧化性,用于饮用水消毒 | |
| B. | 木炭具有还原性,用于制冰箱除味剂 | |
| C. | 氧化铝具有两性,用于工业冶炼铝单质 | |
| D. | 氯化铁溶液呈酸性,用于蚀刻铜电路板 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙二醇 丙三醇 | B. | C6H5-OH C6H5CH2-OH | ||
| C. | C3H6 和C4H8 | D. | C2H6和C10H22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO2的水解产物是Ca(OH)2和H2O2 | B. | NaClO的水解产物之一是HClO | ||
| C. | PCl3的水解产物是PH3和HClO | D. | Mg3N2水解生成NH3和Mg(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com