
【题目】钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。请回答钢铁在腐蚀、防护过程中的有关问题。
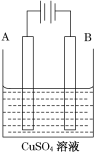
(1)下列哪个装置可防止铁棒被腐蚀________________。

(2)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图。请回答:
①A电极对应的金属是________(写元素名称),B电极的电极反应式是_________________________。
②镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因_________________________。
科目:高中化学 来源: 题型:
【题目】太阳能电池的发展趋向于微型化、薄膜化。最新产品是铜镓(Ga)硒(Se)等化合物薄膜太阳能电池和Si系薄膜太阳能电池。完成下列填空:
(1)Cu+基态时的电子排布式_________;1mol配合离子[Cu(NH3)2]+ 中,含有σ键数目为__________。
(2)已知硼元素与镓元素处于同一主族,BF3分子的空间构型为_____。
(3)与硒同周期相邻的元素为砷和溴,则这三种元素的第一电离能从大到小顺序为_______(用元素符号表示),H2Se的沸点比H2O的沸点低,其原因是___________。
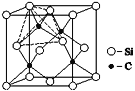
(4)单晶硅的结构与金刚石结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子不成键,则得如图所示的金刚砂结构;在晶体中,每个Si原子周围最近的C原子数目为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,有pH值为12的NaOH溶液100 mL,欲将其pH值变为11,采取下列三种措施(设混合后溶液的体积等于两混合溶液体积之和)。请回答有关问题:
①若加水,应加入约________ mL。
②若用pH=10的NaOH溶液,应加入此NaOH溶液________ mL。
③若用pH=2的盐酸,应加入________ mL。
(2)pH=2的HA、HB两种酸溶液各1mL,分别加水稀释到1000mL, 其pH的变化如图所示
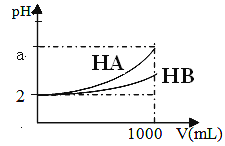
①稀释前两溶液的浓度c(HA)________c(HB)(填>.<.=,或无法确定)
② HB _______ 是弱酸 (填“一定”、“可能”或“一定不”)
③若 a = 5,则HA酸是否是强酸 ____(填“一定是”、“可能是”、 “一定不是”或“无法确定”)
④稀释后的溶液中,由水电离产生的c(H+): HA中_____ HB中(填>.<.=,或无法确定)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,加入2molA和1molB发生如下反应:2A(g)+B(?)![]() 2C(g)+D(g),C的体积分数(C%) 随时间的变化趋势符合右下图关系:下列说法正确的是( )
2C(g)+D(g),C的体积分数(C%) 随时间的变化趋势符合右下图关系:下列说法正确的是( )

A. E点的v(逆)大于F点的v(正)
B. 若在F点时给容器加压,达新平衡时C的浓度将增大
C. 若给容器加热,该反应的平衡常数K将增大
D. 恒温恒容下达平衡后,向容器中再加入2molA和1molB,A的转化率不发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E都是前20号元素中的常见元素,且核电荷数递增。A原子没有中子;B原子次外层电子数与最外层电子数之差等于电子层数;C元素是地壳中含量最高的元素;4.6gD单质与足量盐酸作用可产生2.24LH2(标准状态下);E的一价阴离子的核外电子排布与Ar的核外电子排布相同。请回答下列问题:
(1)写出A、B、D的元素符号:A____;B_____;D_____。
(2)C离子的电子式_____;E的离子结构示意图_____;
(3)实验室里检验E的单质常用的试剂是____;
(4)写出电解D、E形成化合物的水溶液的化学反应方程式_____;
(5)写出由A、B、C、D形成的化合物与由A、C、E形成的化合物发生反应的化学反应方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用纯净的Cu与过量浓HNO3反应制取NO2,实验结果如图所示,对图中曲线的描述正确的是

A. OA段表示开始时,反应速率较快
B. AB段表示反应速率较快,可能因为产物有催化作用
C. BC段表示反应速率最快,在该时间内收集到的气体最多
D. OC线表示随时间增加,反应速率逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了将混有K2SO4、MgSO4的KNO3固体提纯,并制得纯净的KNO3溶液,某同学设计如下实验方案:
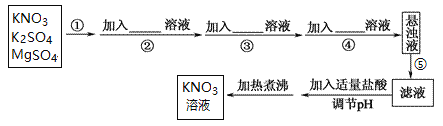
(1)操作①为______。
(2)操作②~④加入的试剂可以为____________。
(3)如何判断SO42-已除尽,简述实验操作____________。
(4)该同学设计的实验方案______(填“合理”或“不合理”),理由是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氯水性质的描述中不正确的是
A. 观察氯水的颜色,发现氯水呈黄绿色,说明氯水中存在Cl2
B. 向氯水中滴入碳酸钠溶液,有气体生成,说明氯水中存在H+
C. 向氯水中滴加硝酸银溶液,有白色沉淀生成,说明氯水中存在Cl-
D. 氯水经光照后,颜色逐渐消失并放出气体,导致溶液的酸性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaH2PO2(次磷酸钠)易溶于水,水溶液近中性,具有强还原性,可用于化学镀银、镍、铬等。一种利用泥磷(含P4和少量CaO、Fe2O3、Al2O3、CaCl2等)为原料制备NaH2PO2·H2O的工艺流程如下:
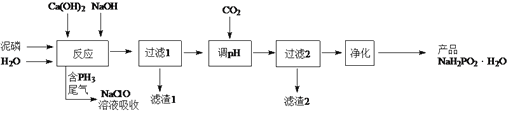
已知P4与两种碱的反应主要有:
Ⅰ. 2Ca(OH)2+P4+4H2O=2Ca(H2PO2)2+2H2↑ Ⅱ. 4NaOH + P4+8H2O = 4NaH2PO2·H2O+2H2↑
Ⅲ. 4NaOH + P4+2H2O = 2Na2HPO3 +2PH3↑ Ⅳ. NaH2PO2+NaOH = Na2HPO3+H2↑
(1) 已知H3PO2是一元中强酸,NaH2PO2是___________(填“正盐”或“酸式盐”)。
(2)尾气中的PH3被NaClO溶液吸收可生成NaH2PO2,从吸收液中获得NaH2PO2·H2O的操作为______________、______________过滤、洗涤和干燥。
(3) 用NiCl2、NaH2PO2溶液化学镀Ni,同时生成H3PO4和氯化物的化学方程式为:______________________。
(4) “反应”在温度和水量一定时,混合碱总物质的量与P4的物质的量之比[n(碱)/ n(磷)]与NaH2PO2产率的关系如图所示。当n(碱)/ n(磷)>2.6时,NaH2PO2的产率随n(碱)/ n(磷)的增大而降低的可能原因是______。
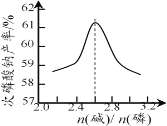
(5) 滤渣2主要成分为___________________ (填化学式)。
(6) “过滤2”的滤液须用Ag2SO4、Ba(OH) 2及Na2S溶液除去其中Cl-及Fe2+等,其中加入的Ag2SO4溶液不宜过量太多,其主要原因是_________________。
(7)在工业上,可以用惰性电极电解NaH2PO2溶液制取磷酸,请写出其阳极反应式_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com