
为了贯彻“循环经济,防止污染”的理念,某校化学课外活动小组利用废干电池作为再生资源。其实验设计如下:

一、实验目的
从废旧电池中提取有用物质,并检验铵盐的纯度。
二、实验材料
废旧1号电池若干节,钳子等实验用品。
三、实验步骤
1.获取铜帽、锌片、石墨电极
2.从黑色混合物的滤液中提取NH4Cl
3.提取二氧化锰
(1)有关干电池的基本构造和工作原理如右上图。
电池总反应为:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+Mn2O3+H2O,干电池工作时负极上的电极反应式为:______________;正极上产生两种气体,则正极的电极反应式为:________________。
(2)用钳子和剪子剪开回收的干电池的锌筒,把铜帽、锌皮和碳棒回收,将电池内的黑色粉末移入小烧杯中。
(3)氯化铵和氯化锌的提取、检验和分离:
①从黑色粉末中提取NH4Cl和ZnCl2等晶体的混合物,主要包括:溶解、_________、蒸发、_________。
②设计简单的实验证明所得晶体中含有 和Zn2+[已知Zn(OH)2是两性氢氧化物且能溶解于氨水生成Zn
和Zn2+[已知Zn(OH)2是两性氢氧化物且能溶解于氨水生成Zn ],并填写下列实验报告。
],并填写下列实验报告。
(a)________,(b)___________,(c)__________,(d)__________,(e)__________,(f)___________。
③最后剩余的黑色残渣的主要成分是MnO2,还有炭黑和有机物等。可用灼烧的方法除去杂质,该实验中需要用到的主要硅酸盐质仪器除酒精灯外还有___________。
(4)晶体中氯化铵质量分数的测定:
已知 与HCHO在水溶液中有如下反应:4
与HCHO在水溶液中有如下反应:4 +6HCHO→(CH2)6N4+4H++6H2O。称取ag样品溶于水,加入足量的HCHO溶液,配成100mL溶液,再取出10mL,滴入酚酞后,再逐滴滴入cmol/L的NaOH溶液,当滴到VmL时,溶液呈现粉红色,整个过程中不考虑杂质参与反应,则晶体中氯化铵的质量分数ω(NH4Cl)为___________。
+6HCHO→(CH2)6N4+4H++6H2O。称取ag样品溶于水,加入足量的HCHO溶液,配成100mL溶液,再取出10mL,滴入酚酞后,再逐滴滴入cmol/L的NaOH溶液,当滴到VmL时,溶液呈现粉红色,整个过程中不考虑杂质参与反应,则晶体中氯化铵的质量分数ω(NH4Cl)为___________。
(1)Zn-2e-=Zn2+;2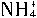 +2e-=2NH3↑+H2↑。
+2e-=2NH3↑+H2↑。
(3)①过滤;结晶
②(a)取所得晶体适量于烧杯中,加水溶解; (b)取(a)所得溶液少许于试管中,加入NaOH溶液并加热;(c)有能使湿润红色石蕊试纸变蓝的气体产生;(d)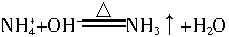 ;(e)取(a)所得少量溶液于试管中,加入NaOH溶液至生成白色沉淀,然后将沉淀分成两份:一份加NaOH溶液至过量;另一份加氨水至过量;(f)两份白色沉淀均溶解
;(e)取(a)所得少量溶液于试管中,加入NaOH溶液至生成白色沉淀,然后将沉淀分成两份:一份加NaOH溶液至过量;另一份加氨水至过量;(f)两份白色沉淀均溶解
③坩埚、玻璃棒。
(4)53.5cV/a%。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com