
 甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景.工业生产甲醇的常用方法是CO(g)+2H2(g)═CH3OH(g)△H<0.
甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景.工业生产甲醇的常用方法是CO(g)+2H2(g)═CH3OH(g)△H<0.分析 (1)依据燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,题干所给量计算32g甲醇燃烧生成二氧化碳和液态水放热,结合热化学方程式书写方法,标注物质聚集状态和对应焓变;
(2)反应为CH3OH(g)?CO(g)+2H2(g),此反应能自发进行的原因是△H-T△S<0,反应是熵增加的反应;
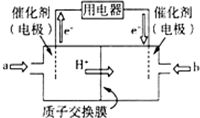
(3)①根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应;
②负极反应式为CH3OH-6e-+H2O=CO2+6H+,正极反应式为O2+4H++4e-=2H2O,根据电解池的工作原理和电极方程式来计算.
解答 解:(1)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热QkJ.32g甲醇燃烧生成二氧化碳和液态水放出热量为32QKJ;则表示甲醇燃烧热的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-32QkJ•mol-1,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-32QkJ•mol-1;
(2)反应为CH3OH(g)?CO(g)+2H2(g),此反应能自发进行的原因是△H-T△S<0,反应是熵增加的反应,
故答案为:反应是熵增加的反应,△S>0;
(3)①根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应,负极反应式为 CH3OH-6e-+H2O=CO2+6H+,正极上氧气得电子发生还原反应,电极反应式为O2+4e-+4H+=2H2O,
故答案为:负;CH3OH-6e-+H2O=CO2+6H+;
②负极反应式为CH3OH-6e-+H2O=CO2+6H+,当转移2mol电子时,左侧质量减轻$\frac{1}{6}$×2×(44-32)g=4g,还要有2molH+通过质子交换膜进入右侧,质量减少2g,正极反应式为O2+4H++4e-=2H2O,右侧质量增加32g×$\frac{1}{4}$×2=16g,加上转移过来的2gH+,因此左右两侧溶液的质量之差为16g+2g+4g+2g=24g,
故答案为:24g;
点评 本题考查了反应热的计算、盖斯定律的应用,题目难度中等,注意掌握热化学方程式的书写原则,明确盖斯定律在反应热计算中的应用,试题培养了学生的分析能力及化学计算能力.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 我国目前使用的主要能源是煤、石油和天然气 | |
| B. | 解决能源危机的方法是开发新能源和节约现有能源,提高能源的利用率 | |
| C. | 开发的新能源包括太阳能、氢能、核能等,它们都是可再生能源 | |
| D. | 提高燃料利用率的方式是科学控制反应,使燃料充分燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol溴苯中含有双键的数目为0.3NA | |
| B. | 标准状况下,22.4 L己烷中含己烷分子数目为NA | |
| C. | 1mol甲醇中含有C-H键的数目为4NA | |
| D. | 标准状况下,11.2 L由CH4和C2H4组成的混合气体中含有氢原子的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1.06gNa2CO3含有Na2CO3分子数为0.01NA个 | |
| B. | 标准状况下,22.4LCCl4含有的分子数为1NA个 | |
| C. | 通常状况下,NA个CO2分子占有的体积为22.4L | |
| D. | 0.5mol/L的MgCl2溶液和1mol/L的NaCl溶液中所含Cl-的物质的量浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl的电子式: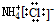 | |
| B. | 氯离子的结构示意图: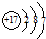 | |
| C. | 乙酸的结构简式:CH3COOH | |
| D. | 硫酸的电离方程式:H2SO4=H++SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com