
 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(H2)=0.015mol/(L?min) | B、v(N2)=0.005mol/(L?min) | C、v(NH3)=0.0017mol/(L?min) | D、v(NH3)=0.01mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①③ | C、③④ | D、②④ |
查看答案和解析>>
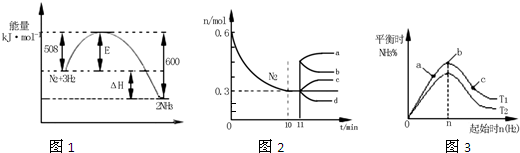
科目:高中化学 来源: 题型:

| A、该反应为自发反应,由图1可得加入适当的催化剂,E和△H都减小 | B、图2中0~10min内该反应的平均速率v(H2)=0.045mol?L-1?min-1,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为d | C、图3中a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点 | D、图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com