
| A. | 某物质不属电解质,就属于非电解质 | |
| B. | SO3溶于水可导电,SO3属于电解质 | |
| C. | 能导电的物质属于电解质,NaCl属于电解质,NaCl晶体可导电 | |
| D. | 已知氧化铝在熔融状态下能导电,则氧化铝在熔融状态下能电离 |
分析 电解质:在水溶液中或熔融状态下能导电的化合物;例:酸、碱、盐,金属氧化物等;
非电解质:在水溶液中或熔融状态下不能导电的化合物;例:有机物,非金属氧化物等;
电解质、非电解质必须是化合物,电解质必须是本身能电离产生自由离子.
解答 解:A.铜、盐酸,既不是电解质也不是非电解质,故A错误;
B.三氧化硫本身不能电离产生自由移动离子,属于非电解质,故B错误;
C.能导电的物质不一定是电解质,如铜;电解质也不一定导电,如氯化钠属于电解质,但是氯化钠晶体不含自由移动离子,所以不导电,故C错误;
D.氧化铝在熔融状态下能电离,产生自由移动离子,所以氧化铝在熔融状态下能导电,故D正确;
故选:D.
点评 本题考查了电解质的判断,关键注意“电解质是化合物,单质和混合物既不是电解质也不是非电解质”,电解质不一定导电,导电的不一定是电解质,题目难度不大.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 丙醇 | B. | 甲醛 | C. | CO | D. | H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3溶于氢碘酸溶液中:Fe2O3+6H+═2Fe3++3H2O | |
| B. | Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| C. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | 在Cu2O固体中加入足量的稀硫酸:Cu2O+2H+═Cu+Cu2++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 结论 |
| A | 用铂丝蘸取某待测液在酒精灯外焰上灼烧,火焰呈紫色(透过蓝色钴玻璃) | 待测试液中一定含有钾元素, 可能含钠元素 |
| B | 向某无色溶液中通入过量的CO2气体,有白色沉淀产生 | 该溶液中一定含有SiO32- |
| C | 向品红溶液中通入某气体后,溶液褪色 | 该气体一定是SO2 |
| D | 向NaOH溶液中滴加MgCl2溶液,产生白色沉淀,继续滴加FeCl3溶液产生红褐色沉淀 | Fe(OH)3的溶解度大于Mg(OH)2的溶解度 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉的主要成分为次氯酸钙 | |
| B. | 实验室可用浓硫酸干燥氨气 | |
| C. | 实验室可用NaOH溶液处理NO2和HCl废气 | |
| D. | 它们对应的含氧酸都是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
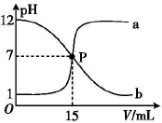
| A. | 盐酸的物质的量浓度与NaOH溶液的物质的量浓度相等 | |
| B. | P点时溶液中c(Na+)=c(Cl-)=c(H+)=c(OH-) | |
| C. | 曲线a是盐酸滴定氢氧化钠溶液的滴定曲线 | |
| D. | 曲线b中滴定前NaOH溶液的体积为150mL |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
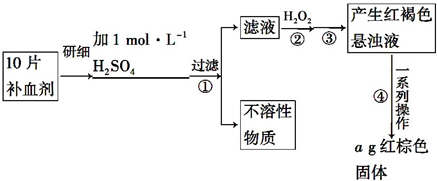
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com