
| A�� | һ��������Ӧ��2CO��g��?CO2��g��+C��s�����Է����У���÷�Ӧ�ġ�H��0 | |
| B�� | ������������Һ�еμ����軯����Һ����Ѫ��ɫ����˵������������Һ�ѱ��� | |
| C�� | ����CH3COONa��Һ�¶ȣ���ˮ�����ӻ�������pHֵ������ | |
| D�� | ��ͬ���ʵ���Ũ�ȵ�������Һ����NH4HSO4��NH4Cl��NH3•H2O��ˮ����̶��ɴ�С��˳���ǣ��٣��ڣ��� |
���� A����Ӧ�Է����е��ж������ǡ�H-T��S��0����Ӧ�Է����У���H-T��S��0����Ӧ���Է����У�
B�����軯�������������Ӳ�����������
C��ˮ�ĵ���������ˮ�ⶼ�����ȹ��̣�
D����������ˮ�ĵ��룬ˮ����δٽ�ˮ���룮
��� �⣺A����Ӧ�Է����е��ж������ǡ�H-T��S��0����Ӧ�Է����У���H-T��S��0����Ӧ���Է����У�һ��������Ӧ��2CO��g��?CO2��g��+C��s�����Է����У��÷�Ӧ�ġ�S��0�����Ը÷�Ӧ�ġ�H��0����A����
B�����軯�������������Ӳ���������������������������Һ�еμ����軯����Һ����Һ��Ѫ��ɫ��˵����Һ�ѱ��ʣ���B����
C��ˮ�ĵ���������ˮ�ⶼ�����ȹ��̣������¶ȣ��ٽ�ˮ�ĵ���������ˮ�⣬ˮ�����ӻ�������pHֵ������C��ȷ��
D����������ˮ�ĵ��룬�����������������������������Ũ����ͬʱ��ˮ�����Ƴ̶���ͬ��ˮ����δٽ�ˮ���룬��ͬ���ʵ���Ũ�ȵ�������Һ����NH4HSO4��NH4Cl��NH3•H2O��NH4HSO4�����������Ũ�ȴ���NH3•H2O��������������ӵ�Ũ�ȣ����Ԣٶ�ˮ�ĵ�������Ƴ̶ȱȢ۴�ˮ����̶��ɴ�С��˳���ǣ��ڣ��ۣ��٣���D����
��ѡC��
���� ���⿼���˷�Ӧ�Է��Ե��жϣ����Ӽ��飬�����ˮ�⣬Ӱ��ˮ�ĵ������صȣ�Ϊ��Ƶ����ͳ������ͣ��漰��֪ʶ��϶࣬ע����ػ���֪ʶ�Ļ��ۣ���Ŀ�Ѷ��еȣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
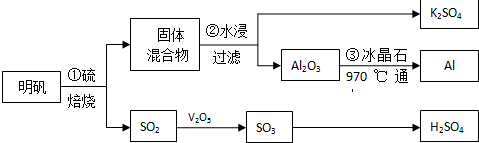
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2��3 | B�� | 3��2 | C�� | 2��5 | D�� | 5��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 6NA | B�� | 12 NA | C�� | 2 NA | D�� | 4 NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Һʱ����Һ©�����²�Һ����¿ڷų����ϲ�Һ����Ͽڵ��� | |
| B�� | ����ʱ��Ӧʹ�¶ȼ�ˮ����������ƿ��֧�ܿڴ� | |
| C�� | ����ʱ��Ӧʹ������е�ˮ����ȫ���ɺ���ֹͣ���� | |
| D�� | ����ʱ��Ҫ������ˮ��û����2-3�Σ��Գ�ȥ���ܸ����ڳ����ϵ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
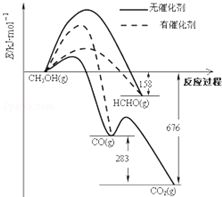 ��1�����dz��ô�����ѡ��Ӧ���еķ�����ͼ��ʾΪһ��������1mol CH3OH��O2������Ӧʱ������CO��CO2��HCHO�������仯ͼ����Ӧ��O2��g����������H2O��g����ȥ����
��1�����dz��ô�����ѡ��Ӧ���еķ�����ͼ��ʾΪһ��������1mol CH3OH��O2������Ӧʱ������CO��CO2��HCHO�������仯ͼ����Ӧ��O2��g����������H2O��g����ȥ����| �¶ȣ��棩 | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ̼��ˮ��Ӧ����131.3kJ���� | |
| B�� | 1mol̼��1molˮ��Ӧ���� һ����̼��������������131.3kJ���� | |
| C�� | 1mol C��S����1 mol H2O��g���������ܺʹ���1mol H2��g����1mol CO��g�������� | |
| D�� | 1mol��̬̼��1molˮ������Ӧ����һ����̼�����������������131.3kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢ� | B�� | �ܢ� | C�� | ������ | D�� | ȫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com