
【题目】油脂不仅是营养物质和主要食物,也是一种重要的上业原料。下面是以油脂为主要原料获得部分产品的合成路线:
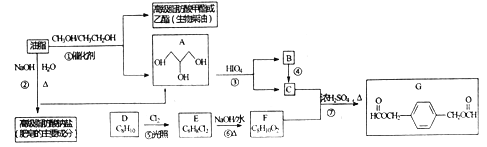
已知:
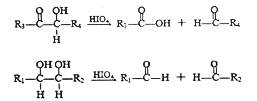
(R1、R2、R3与R4可能是氢、烃基或其他基团)
回答下列问题:
(1)下列关于油脂的说法正确的是____________. (填标号)
a.油脂包括植物油和脂肪,属于酯类
b.天然油脂是混合物,无固定的熔点和沸点
c.油脂属天然高分子化合物
d.硬化油又叫人造脂肪,便于储存和运输,但容易被空气氧化变质
(2)G中官能团的名称为________,反应①的反应类型为__________
(3)用系统命名法写出A的名称__________, C与F反应生成G的化学方程式为_____。
(4)二元取代芳香化合物H是G的同分异构体,H满足下列条件:
① 能发生银镜反应,② 酸性条件下水解产物物质的最之比为2: 1,③ 不与NaHCO3溶液反应。
则符合上述条件的H共有_____种(不考虑立体结构,不包含G本身),其中核磁共振氢谱为五组峰的结构简式为_________________(写出一种即可)。
(5)写出从HOCH2CH2OH![]() HCOOCH2CH2OOCH 的合成路线(无机试剂任选,合成路线参照题中的书写形式)________________。
HCOOCH2CH2OOCH 的合成路线(无机试剂任选,合成路线参照题中的书写形式)________________。
【答案】 ab 酯基 取代反应 1,2,3—丙三醇 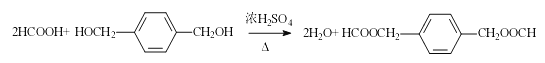 11
11 
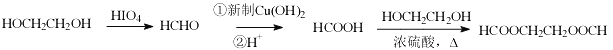
【解析】油脂水解得到A为![]() ,结合信息③可以A氧化生成HCHO、HCOOH,B氧化得到C,故B为HCHO,C为HCOOH.芳香烃D与氯气在光照条件下发生侧链取代反应生成E,E分子中只有两种不同化学环境的H原子,则D为
,结合信息③可以A氧化生成HCHO、HCOOH,B氧化得到C,故B为HCHO,C为HCOOH.芳香烃D与氯气在光照条件下发生侧链取代反应生成E,E分子中只有两种不同化学环境的H原子,则D为![]() ,E为
,E为![]() ,F为
,F为![]() ;
;
(1)a.油脂是高级脂肪酸的甘油酯,包括植物油和脂肪,属于酯类,故a正确;b.组成天然油脂的高级脂肪酸不一定相同,则天然油脂是混合物,无固定的熔点和沸点,故b正确;c.天然高分子化合物主要是指淀粉、蛋白质和纤维素,油脂不属于天然高分子化合物,故c错误;d.油脂的氢化产物为硬化油又叫人造脂肪,便于储存和运输,无不饱和碳碳双键,不易被空气氧化变质,故d错误;答案为ab;
(2)![]() 中官能团的名称为酯基,反应①是油脂的醇解,属取代反应;
中官能团的名称为酯基,反应①是油脂的醇解,属取代反应;
(3)![]() 的系统命名法写出A的名称为 1,2,3—丙三醇;HCOOH与
的系统命名法写出A的名称为 1,2,3—丙三醇;HCOOH与![]() 反应生成
反应生成![]() 的化学方程式为
的化学方程式为![]() 。
。
(4)二元取代芳香化合物H说明苯环上只有二个取代基;同时满足:
① 能发生银镜反应说明有醛基或HCOO—② 酸性条件下水解产物物质的最之比为2: 1,说明有二个酯基;③ 不与NaHCO3溶液反应,说明没有羧基;其中有一个甲基,另一个为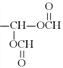 ,共有邻、间、对位3种结构,两个
,共有邻、间、对位3种结构,两个![]() 基有间、邻位2种情况;一个
基有间、邻位2种情况;一个![]() 另一个基团可能是—CH2CH2OOCH或—CH(CH3)OOCH,共有邻、间、对位6种结构,则符合上述条件的H共有11种,其中核磁共振氢谱为五组峰的结构简式为
另一个基团可能是—CH2CH2OOCH或—CH(CH3)OOCH,共有邻、间、对位6种结构,则符合上述条件的H共有11种,其中核磁共振氢谱为五组峰的结构简式为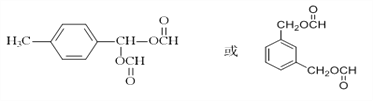 ;
;
(5)用HOCH2CH2OH![]() HCOOCH2CH2OOCH的合成路线为
HCOOCH2CH2OOCH的合成路线为![]() 。
。


科目:高中化学 来源: 题型:
【题目】为探究外界条件对反应:mA(g)+nB(g)cZ(g)△H的影响,以A和B物质的量之比为m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数.实验结果如图所示,下列判断正确的是( )
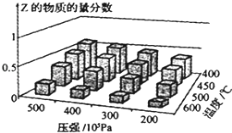
A.△H>0
B.升温,正、逆反应速率都增大,平衡常数减小
C.增大压强,Z的含量减小
D.在恒温恒容下,向已达到平衡的体系中加入少量Z,达到平衡后Z的含量减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。 请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)________________。
(2)X与Y能形成多种化合物,其中相对分子质量最小的分子中只含有_________键(填“离子”、“极性”或“非极性”)。
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系:![]() (在水溶液中进行)其中,C是溶于水显酸性的气体;D是淡黄色固体。
(在水溶液中进行)其中,C是溶于水显酸性的气体;D是淡黄色固体。
写出C的结构式:________;D的电子式:________。
①如果A、B均由三种元素组成,B为两性不溶物,由A转化为B的离子方程式为________________。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。由A转化为B的离子方程式为___________________。(提示:强酸弱碱盐显酸性,强碱弱酸显碱性)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体0.1mol,完全燃烧得0.15 molCO2和3.6 g H2O,下列关于该混合气体的说法正确的是
A. 一定有乙烯 B. 一定没有乙烯 C. 一定有乙烷 D. 一定有甲烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是( )
A.测0.1mol/L氨水的pH为11:NH3·H2O![]() NH4++OH-
NH4++OH-
B.将Na块放入水中,产生气体:2Na+2H2O=2NaOH+H2↑
C.用CuCl2溶液做导电性实验,灯泡发光:CuCl2 =Cu2++2Cl-
D.Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O=2AlO2-+3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)配制FeCl3溶液时,需将固体溶于较浓的盐酸后按需要进行稀释,用离子方程式解释其原因 。
(2)用离子方程式表示出泡沫灭火器的原理 。
(3)实验室中常用NaOH溶液来进行洗气和提纯,当100mL 3mol·L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中离子浓度由大到小的顺序为 。
(4)常温下,浓度均为0.1mol/L的下列五种溶液的PH值如下表所示:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①根据表中数据,将浓度均为0.01mol· L-1的下列四种酸的溶液分别稀释100倍,pH变化最小的是 。
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是 。
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa
B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+2NaClO═Na2CO3+2HClO
D.NaHCO3+HCN═NaCN+H2O+CO2
(5)已知在Cu2+、Mg2+、Fe2+浓度相同的溶液中,其开始沉淀时的pH如下:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
若向该溶液中滴加NaOH溶液,则先沉淀的是 (填离子符号),
判断Ksp[Fe(OH)2] Ksp[Mg(OH)2](填“>”、“=”或“<”)。
已知Ksp[Cu(OH)2]=2.5×10-20,若向该溶液中加入生石灰调节其pH,当pH= 时,溶液中Cu2+沉淀完全。[已知1g2=0.3]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某金属与稀硝酸反应生成一种硝酸盐,该硝酸盐受热分解生成NO2、O2和一种固体,该固体中金属元素的化合价比原硝酸盐中该金属的化合价高,则该硝酸盐分解后生成的NO2和O2的物质的量之比为 ( )
A. 8∶1 B. 4∶1 C. 2∶1 D. 1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】里约奥运会游泳池误多加H2O2导致水体变绿,发生反应H2O2+Cl2===2HCl+O2。该反应属于( )
A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com