
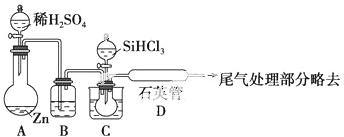
分析 (1)高温下,碳和二氧化硅反应生成硅和一氧化碳;
(2)利用沸点的不同提纯SiHCl3,可用蒸馏的方法;
(3)①生成的氢气含有水蒸气,用浓H2SO4干燥;加热促使SiHCl3气化;
②SiHCl3和氢气反应有硅单质生成,根据硅的颜色判断D装置中的颜色变化;SiHCl3和H2反应生成硅和氯化氢;
③氢气是可燃性气体,易产生爆炸,为防止安全事故的发生,所以先通一段时间H2,将装置中的空气排尽;
④取少量产品于试管中加盐酸溶解,再滴加氯水和KSCN(aq),若出现红色说明含Fe,若不出现红色说明不含Fe.
解答 解:(1)高温下,碳做还原剂时,生成CO,即2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.故答案为:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(2)利用沸点的不同提纯SiHCl3,可用蒸馏的方法,故答案为:蒸馏;
(3)①锌和稀硫酸的反应是放热反应,所以生成的氢气含有水蒸气,为干燥氢气,一般选用浓H2SO4干燥;气体的反应速率较大,所以加热的目的是使SiHCl3气化,
故答案为:浓硫酸;使SiHCl3气化;
②高温下,SiHCl3和氢气反应生成硅单质,硅单质是灰黑色固体,所以D装置中的现象是:石英管的内壁附有灰黑色晶体,反应方程式为:SiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl,
SiHCl3与过量的H2在1000℃~1100℃反应制得纯硅,温度太高,普通玻璃管易熔化,
故答案为:石英管的内壁附有灰黑色晶体;SiHCl3与过量的H2在1000℃~1100℃反应制得纯硅,温度太高,普通玻璃管易熔化;SiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl;
③氢气是可燃性气体,当氢气的量达到一定时易产生爆炸,为防止安全事故的发生,所以先通一段时间H2,将装置中的空气排尽,
故答案为:先通一段时间H2,将装置中的空气排尽;
④铁能和酸反应生成亚铁离子,亚铁离子有还原性,亚铁离子能被氯水氧化生成铁离子,铁离子遇硫氰化钾溶液变红色,所以可以用氯水和硫氰化钾溶液检验铁的存在,故选bd.
点评 本题考查了实验方案设计的有关知识,铁离子和亚铁离子的检验在高考题中出现,这种类型的题是高考的热点,是学习的重点,会根据实验目的和物质的性质选取实验装置和实验药品,然后进行相应的实验.


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:解答题
 车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”.活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量(n/mol)如下表:
车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”.活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量(n/mol)如下表:| 物质 T/℃ | 活性炭 | NO | E | F |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钱恩 | B. | 屠呦呦 | C. | 弗莱明 | D. | 莫言 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①②⑤ | C. | ①②③⑤ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
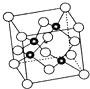 砷化镓属于第三代半导体,其晶胞结构如如图所示.请回答下列问题:
砷化镓属于第三代半导体,其晶胞结构如如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电力平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A. | NaCN溶液中通入少量CO2发生的离子反应为:2CN-+H2O+CO2=2HCN+CO${\;}_{3}^{2-}$ | |
| B. | 处理含CN-废水时,如用NaOH溶液调节pH至9,此时c(CN-)<c(HCN) | |
| C. | 中和等体积、等pH的甲酸溶液和氢氰酸溶液消耗NaOH的物质的量前者小于后者 | |
| D. | 等体积、等物质的量浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 现.
现.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才发生的化学反应,反应物的总能量可能高于生成物的总能量 | |
| B. | 已知:H2(g)+F2(g)═2HF(g)△H=-270 kJ•mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | |
| C. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)═2NH3(g)△H=-38.6 kJ•mol-1 | |
| D. | 已知:C(s,金刚石)═C(s,石墨)△H=-1.5 kJ•mol-1,说明金刚石更稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com