
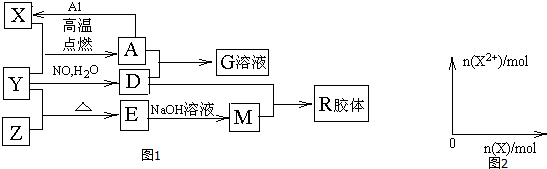
 .
.分析 A俗称磁性氧化铁,则A为Fe3O4;E是不溶于水的酸性氧化物,能与氢氟酸反应,则E是SiO2,根据转化关系,可知X为铁、Y为O2、Z为Si、D为HNO3、M为Na2SiO3、G为Fe(NO3)3,R为H2SiO3,然后结合物质的性质及化学用语来解答
解答 解:A俗称磁性氧化铁,则A为Fe3O4;E是不溶于水的酸性氧化物,能与氢氟酸反应,则E是SiO2,根据转化关系,可知X为铁、Y为O2、Z为Si、D为HNO3、M为Na2SiO3、G为Fe(NO3)3,R为H2SiO3.
(1)由上述分析可知,X为Fe,位于第四周期第Ⅷ族,M为Na2SiO3,含有离子键、共价键,
故答案为:第四周期第Ⅷ族;离子键、共价键;
(2)SiH4的电子式为: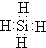 ,故答案为:
,故答案为: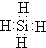 ;
;
(3)1mol Al反应转化为Fe时(所有物质均为固体),放出a kJ热量,则8molAl参加反应放出的热量为8akJ,所以反应的热化学方程式为8Al(s)+3Fe3O4(s)=9Fe(s)+4Al2O3(s)△H=-8a kJ/mol,
故答案为:8Al(s)+3Fe3O4(s)=9Fe(s)+4Al2O3(s)△H=-8a kJ/mol;
(3)四氧化三铁与过量的稀硝酸反应生成硝酸铁、NO与水,反应离子方程式为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O,
故答案为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O;
(4)铁和稀硝酸反应,开始铁全部被硝酸氧化为硝酸铁,故开始阶段Fe2+的量为0,随着铁的加入,多余的铁又和Fe3+反应而生成Fe2+,故Fe2+的量逐渐会增大直至到最大值,以后不变,反应过程中生成的气体为NO,令Fe2+的最大物质的量为xmol,根据电子转移守恒可知,NO的物质的量=$\frac{xmol×2}{3}$,根据N元素守恒可知:$\frac{xmol×2}{3}$+2x mol=4 mol,解得x=1.5,根据电子转移守恒可知,由Fe+2Fe3+=3Fe2+,可知开始产生NO时Fe的物质的量等于Fe3+的物质的量,即为1.5mol×$\frac{2}{3}$=1mol,故n(Fe2+)随n(Fe)变化的示意图为: ,
,
故答案为: .
.
点评 本题考查无机物推断,根据物质的性质进行推断,(4)为易错点,注意根据反应的方程式计算,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | O |
| 1 | ① | ⑩ | ||||||
| 2 | ⑥ | ⑦ | ||||||
| 3 | ② | ③ | ④ | ⑧ | ||||
| 4 | ⑤ | ⑨ |
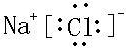 ,高温下灼烧该化合物火焰呈黄色.
,高温下灼烧该化合物火焰呈黄色.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
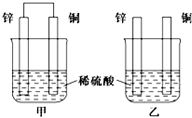 (1)将纯锌片和纯铜片按如图方式插入相同浓度的稀硫酸中一段时间,回答下列问题:
(1)将纯锌片和纯铜片按如图方式插入相同浓度的稀硫酸中一段时间,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y、Z、W三种元素组成化合物的化学式可能为ZWY | |
| B. | Z与Y、Z与W形成的化合物的化学键类型可能完全相同 | |
| C. | 简单离子的半径:R>W>Y>Z | |
| D. | 因非金属性Y>R,所以X与Y组成化合物的沸点低于X与R组成的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应不需要加热即可进行反应 | |
| B. | 反应物的总能量低于生成物的总能量 | |
| C. | 反应物的总键能高于生成物的总键能 | |
| D. | 理论上可以使该反应的化学能直接转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大容器体积 | B. | 体积不变,充入N2使压强增大 | ||
| C. | 体积不变,充入He使压强增大 | D. | 压强不变,充入N2使体积增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com