
【题目】下列物质加入水中,对水的电离能产生促进作用的是
A. NH4Cl B. NaOH C. NaCl D. H2SO4
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.皂化反应指的是油脂的酸性水解
B.葡萄糖和果糖互为同分异构体
C.部分蛋白质遇浓硝酸变黄色
D.驴皮熬制的阿胶中含有丰富的蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】南海是一个巨大的资源宝库,开发利用这些资源是科学研究的重要课题。下图为海水资源利用的部分过程,有关说法正确的是( )

A. 海水淡化的方法主要有蒸馏法、电渗析法、冰冻法
B. 氯碱工业中采用阴离子交换膜可提高产品的纯度
C. 由MgCl2·6H2O得到无水MgCl2的关键是要低温小火烘干
D. 溴工业中③、④的目的是为了富集溴元素,溴元素在反应③、⑤中均被氧化,在反应④中被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氧磷(POCl3)常用作半导体掺杂剂及光导纤维原料,实验室制备POCl3并测定产品含量的实验过程如下:
Ⅰ.制备POCl3。
采用氧气氧化液态PCl3法制取POCl3,实验装置(加热及夹持仪器略)如图所示:
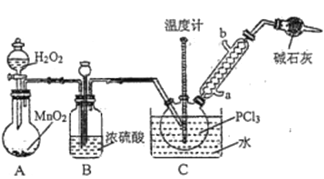
已知:①Ag++SCN-=AgSCN↓;Ksp(AgCl)>Ksp(AgSCN);磷酸银溶于硝酸。
②PCl3和POCl3的相关信息如下表:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | -112.0 | 76.0 | 137.5 | 两者互溶,均为无色液体,遇水均剧烈反应生成含氧酸和氯化氢 |
POCl3 | 2.0 | 106.0 | 153.5 |
(1)POCl3遇水反应的化学方程式为_________________________________________。
(2)装置B的作用除干燥O2外,还有_________________________________________。干燥管的作用是_______________。
(3)反应温度要控制在60~65℃,原因是_____________________________________________。
Ⅱ.测定POCl3产品的含量。
实验步骤:
①制备POCl3实验结束后,待三颈烧瓶中的液体冷却至室温,准确称取30.7gPOCl3产品,置于盛有60.00mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00mL溶液。
②取10.00mL溶液于锥形瓶中,加入10.00mL3.2mol/LAgNO3标准溶液。
③加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
④以X为指示剂,用0.2mol/LKSCN溶液漓定过量的AgNO3溶液,达到滴定终点时共用去10.00mLKSCN溶液。
(4)步骤③中加入硝基苯的作用是___________________________________________。若无此操作,所测产品中氯元素的质量分数将会__________(填“偏大”、“偏小”或“不变”)。
(5)步骤④中X为__________,产品中POCl3的质量分数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2:326.26.26 联合国将2011年定为“国际化学年”,主题是“化学,人类的生活,人类的未来”,以鼓励青年人热爱化学。学习化学应该明白“从生活中来,到生活中去”的道理。

请填空:
(1)成人每天应从食物中摄取的几种元素的质量分别为: Mg 300 mg、Ca 800 mg、Fe 14 mg、Cu 1.6 mg,这些元素的物质的量之比为_________。
(2)病人输液用的葡萄糖注射液是葡萄糖(化学式C6H12O6)的水溶液,其标签上的部分内容如右图所示。利用标签所提供的信息,计算出该注射液中葡萄糖的物质的量浓度为__________。
(3)SO2有毒,但葡萄酒里都含有微量SO2,起保鲜、杀菌和抗氧化作用,抗氧化作用利用了SO2的_______性。“硅胶”常用作实验室和袋装食品、瓶装药品等的干燥剂,也可以用作_______的载体。实验室可用________溶液来鉴别某未知液是苏打水还是水玻璃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一块镁铝合金,其中镁与铝的质量比是8∶9。加入200mL稀HNO3使其恰好完全溶解,产生NO气体在标准状况下的体积为3.36L,然后向溶液中再加入NaOH溶液至沉淀质量不再发生变化,过滤、洗涤、干燥、称量。
(1)合金中铝的物质的量为_________,最后所得沉淀的质量为_________。
(2)另取200 mL原稀HNO3和300 mL稀硫酸组成混合液,向其中加铜粉使之充分反应,得到只含一种溶质的溶液,求所加稀硫酸的物质的量浓度。(无解题过程不给分)____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下MnO2氧化浓HCl的反应方程式如下:
(1)MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,则MnO2、Cl2的氧化性由强到弱的顺序是:______________________。
MnCl2+Cl2↑+2H2O,则MnO2、Cl2的氧化性由强到弱的顺序是:______________________。
(2)用“双线桥法”标明反应中电子转移的方向和数目_______________________
(3)浓盐酸在反应中显示出来的性质是________(填编号)
A只有还原性 B还原性和酸性 C只有氧化性 D氧化性和酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com